Thiocétone
Une thiocétone (ou thione) est toute molécule ayant le groupe R2C=S. C'est comme une cétone dont l'atome d'oxygène est remplacé par un atome de soufre. L'atome de soufre a une double liaison avec l'atome de carbone. Il conserve également deux paires isolées.
Les thiocétones sont très réactifs. C'est parce qu'elles sont de bons électrophiles. Beaucoup d'entre eux sont instables. Ils veulent former des anneaux. Ils le font avec des réactions de cycloaddition, similaires à la réaction de Diels-Alder.
Si l'un des groupes R est l'hydrogène, la molécule est la version soufrée d'un aldéhyde. On l'appelle un thial, et il est encore plus réactif qu'une thiocétone.
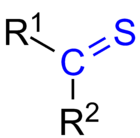
Structure générale d'une thiocétone
Questions et réponses
Q : Qu'est-ce qu'une thiocétone ?
R : Une thiocétone est une molécule comportant le groupe R2C=S, qui ressemble à une cétone dont l'atome d'oxygène a été remplacé par un atome de soufre.
Q : Comment l'atome de soufre est-il lié à l'atome de carbone dans une thiocétone ?
R : L'atome de soufre a une double liaison avec l'atome de carbone.
Q : Pourquoi les thiocétones sont-elles très réactives ?
R : Les thiokétones sont très réactives parce qu'elles sont de bons électrophiles.
Q : Que se passe-t-il lorsque les thiocétones veulent former des anneaux ?
R : Lorsque les thiocétones veulent former des cycles, elles le font par des réactions de cycloaddition, similaires à la réaction de Diels-Alder.
Q : Qu'est-ce qu'un thial ?
R : Un thial est la version soufrée d'un aldéhyde. Il s'agit d'une molécule dont R2C=S et dont l'un des groupes R est un hydrogène.
Q : Comment la réactivité d'un thial se compare-t-elle à celle d'une thiocétone ?
R : Un thial est encore plus réactif qu'une thiocétone.
Q : Les thiocétones et les thiaux sont-ils des molécules stables ?
R : De nombreuses thiocétones sont des molécules instables, tandis que les thiaux sont encore plus réactifs que les thiocétones.
Rechercher dans l'encyclopédie