Sulfoxyde
Un sulfoxyde est une molécule qui possède un atome de soufre lié à deux carbones et un atome d'oxygène. Il provient de l'oxydation des thioéthers, sans aller jusqu'à la sulfone. Comme de nombreuses molécules contenant du soufre, le sulfoxyde peut parfois avoir une odeur très forte.
Les sulfoxydes peuvent être écrits avec la formule générale R-S(=O)-R'. Le soufre a une double liaison avec l'oxygène, et des liaisons simples avec les carbones. Il ne reste donc qu'une seule paire sur l'atome. Cela signifie que la forme de cet atome est tétraédrique. Cela signifie également que le soufre peut être un centre chiral. Les sulfoxydes sont utilisés comme de bons ligands pour les métaux de transition.
Une molécule importante de ce type est le sulfoxyde de diméthyle. Elle est également appelée DMSO. Il est utilisé comme solvant pour de nombreuses réactions, notamment en biochimie.
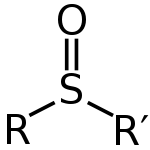
Structure générale d'un sulfoxyde
Questions et réponses
Q : Qu'est-ce qu'un sulfoxyde ?
R : Un sulfoxyde est une molécule dont l'atome de soufre est lié à deux carbones et à un atome d'oxygène.
Q : D'où vient le sulfoxyde ?
R : Le sulfoxyde provient de l'oxydation des thioéthers sans aller jusqu'à la sulfone.
Q : Quelle est la formule générale des sulfoxydes ?
R : La formule générale des sulfoxydes est R-S(=O)-R'.
Q : Quelle est la forme de l'atome dans les sulfoxydes ?
R : La forme de l'atome dans les sulfoxydes est tétraédrique.
Q : Le soufre peut-il être un centre chiral dans les sulfoxydes ?
R : Oui, le soufre dans les sulfoxydes peut être un centre chiral.
Q : Qu'est-ce que le sulfoxyde de diméthyle et quelle est son utilisation ?
R : Le sulfoxyde de diméthyle, également connu sous le nom de DMSO, est une importante molécule de sulfoxyde et est utilisé comme solvant pour de nombreuses réactions, en particulier en biochimie.
Q : Pourquoi les sulfoxydes sont-ils utilisés comme de bons ligands pour les métaux de transition ?
R : Les sulfoxydes sont de bons ligands pour les métaux de transition en raison de leur capacité à se coordonner avec les ions métalliques grâce à la paire d'électrons sur l'atome de soufre.
Rechercher dans l'encyclopédie