SN2
La réaction SN2 (également connue sous le nom de substitution nucléophile bimoléculaire) est une réaction de substitution en chimie organique. C'est un type de substitution nucléophile, où une paire isolée d'un nucléophile attaque un centre électrophile déficient en électrons et se lie à lui. Ceci expulse un autre groupe appelé "groupe de départ". Ainsi, le groupe entrant remplace le groupe sortant en une seule étape. Étant donné que deux espèces réagissant sont impliquées dans l'étape lente et déterminante de la réaction, cela conduit au nom de substitution nucléophile bimoléculaire, ou SN2. Chez les chimistes inorganiques, la réaction SN2 est souvent connue sous le nom de mécanisme d'échange.
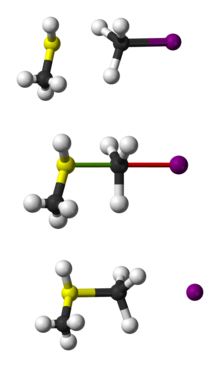
Représentation de la réaction SN2 de CH3SH avec CH3I
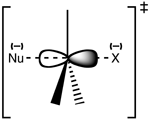
Structure de l'état de transition du SN2
Mécanisme de réaction
La réaction se produit le plus souvent au niveau d'un centre de carbone sp3 aliphatique auquel est fixé un groupe partant stable et électronégatif - "X" - souvent un atome d'halogénure. La rupture de la liaison C-X et la formation de la nouvelle liaison C-Nu se produisent simultanément pour former un état de transition dans lequel le carbone sous attaque nucléophile est pentacoordonné, et approximativement sp2 s'hybride. Le nucléophile attaque le carbone à 180° par rapport au groupe de départ, car c'est ce qui assure le meilleur chevauchement entre la paire isolée du nucléophile et l'orbitale antiliaison C-X σ*. Le groupe sortant est alors poussé du côté opposé et le produit est formé.
Si le substrat soumis à une attaque nucléophile est chiral, cela peut conduire, mais pas nécessairement, à une inversion de la stéréochimie, appelée inversion de Walden.
Dans un exemple de la réaction SN2, l'attaque de OH- (le nucléophile) sur un bromoéthane (l'électrophile) donne de l'éthanol, avec le bromure éjecté comme groupe de départ :
Une réaction SN2 se produit si la voie d'attaque arrière n'est pas bloquée par d'autres atomes de la molécule (entravée stériquement par des substituants sur le substrat). Ainsi, ce mécanisme se produit généralement au niveau d'un centre de carbone primaire non entravé. S'il y a un encombrement stérique sur le substrat près du groupe sortant, comme dans un centre de carbone tertiaire, la substitution utilisera un mécanisme SN1 plutôt que SN2, (un SN1 serait également plus probable avec des molécules bloquées car un intermédiaire de carbocation suffisamment stable pourrait être formé).
Dans la chimie de coordination, la substitution associative procède par un mécanisme similaire à celui de SN2.
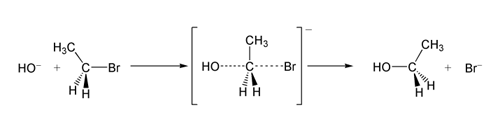
Réaction SN2 du bromoéthane avec l'ion hydroxyde.
Facteurs affectant le rythme de la réaction
Quatre facteurs influent sur le rythme de la réaction :
- Substrat. Le substrat joue le rôle le plus important dans la détermination de la vitesse de réaction. En effet, le nucléophile attaque par l'arrière du substrat, rompant ainsi la liaison entre le groupe carboné et le groupe de départ et formant la liaison carbone-nucléophile. Par conséquent, pour maximiser la vitesse de la réaction SN2, l'arrière du substrat doit être aussi libre que possible. Globalement, cela signifie que le méthyle et les substrats primaires réagissent le plus rapidement, suivis par les substrats secondaires. Les substrats tertiaires ne participent pas aux réactions SN2, en raison de l'encombrement stérique.
- Nucléophile. Comme le substrat, l'encombrement stérique affecte la force du nucléophile. L'anion méthylate, par exemple, est à la fois une base forte et un nucléophile parce qu'il est un nucléophile méthylique, et est donc très libre. Le tert-butoxyde, par contre, est une base forte, mais un nucléophile pauvre, car ses trois groupes méthyle l'empêchent d'approcher le carbone. La force du nucléophile est également affectée par la charge et l'électronégativité : la nucléophilie augmente avec l'augmentation de la charge négative et la diminution de l'électronégativité. Par exemple, OH- est un meilleur nucléophile que l'eau, et I- est un meilleur nucléophile que Br- (dans les solvants protiques polaires). Dans un solvant aprotique polaire, la nucléophilie augmente d'une colonne du tableau périodique car il n'y a pas de liaison hydrogène entre le solvant et le nucléophile. Dans ce cas, la nucléophilie reflète la basicité. I- serait donc un nucléophile plus faible que Br- car il s'agit d'une base plus faible.
- Solvant. Le solvant affecte la vitesse de réaction car les solvants peuvent ou non entourer un nucléophile, gênant ou non son approche de l'atome de carbone. Les solvants aprotiques polaires, comme le tétrahydrofuranne, sont de meilleurs solvants pour cette réaction que les solvants protiques polaires, car les solvants protiques polaires seront solvatés par la liaison hydrogène du solvant avec le nucléophile. Cela l'empêche d'attaquer le carbone avec le groupe de départ.
- Départ du groupe. Le groupe qui part a une incidence sur le taux de réaction. Plus le groupe partant est stable, plus il est probable que les deux électrons de son groupe partant se lient avec lui lorsque le nucléophile attaque le carbone. Par conséquent, plus le groupe de départ est faible en tant que base conjuguée, meilleur est le groupe de départ. De même, plus l'acide correspondant est fort, meilleur est le groupe qui part. Les halogénures (sauf le fluorure) et le tosylate sont des exemples de bons groupes sortants. Mais HO- et H2N- ne sont pas de bons groupes sortants.
Cinétique de réaction
La vitesse d'une réaction SN2 est du second ordre, car l'étape de détermination de la vitesse dépend de la concentration de nucléophiles [Nu-] ainsi que de la concentration du substrat [RX].
r = k [RX] [Nu-]
Il s'agit d'une différence essentielle entre les mécanismes SN1 et SN2. Dans la réaction SN1, le nucléophile attaque après que l'étape de limitation du taux est terminée. Mais dans une réaction SN2, le nucléophile force le groupe qui part dans l'étape de limitation. En d'autres termes, la vitesse de la réaction SN1 dépend uniquement de la concentration du substrat, tandis que la vitesse de la réaction SN2 dépend de la concentration du substrat et du nucléophile. Dans les cas où les deux mécanismes sont possibles (par exemple à un centre de carbone secondaire), le mécanisme dépend du solvant, de la température, de la concentration du nucléophile ou du groupe sortant.
Les réactions SN2 sont généralement favorisées dans les halogénures d'alkyle primaires ou secondaires avec un solvant aprotique. Elles se produisent à un taux négligeable dans les halogénures d'alkyle tertiaires en raison de l'encombrement stérique.
Le SN2 et le SN1 sont deux extrêmes d'une échelle de réaction mobile. Il est possible de trouver de nombreuses réactions qui présentent à la fois le caractère de SN2 et de SN1 dans leurs mécanismes. Par exemple, il est possible d'obtenir une paire d'ions de contact formée à partir d'un halogénure d'alkyle dans lequel les ions ne sont pas complètement séparés. Lorsque ceux-ci sont substitués, la stéréochimie est inversée (comme pour SN2) pour de nombreuses molécules en réaction, mais quelques-unes peuvent conserver leur configuration. Les réactions SN2 sont plus courantes que les réactions SN1.
Concours E2
Une réaction secondaire courante des réactions SN2 est l'élimination de l'E2 : l'anion entrant peut agir comme une base plutôt que comme un nucléophile, en éliminant un proton et en conduisant à la formation de l'alcène. Cet effet peut être démontré dans la réaction en phase gazeuse entre un sulfonate et un simple bromure d'alkyle qui a lieu à l'intérieur d'un spectromètre de masse :

Dans le cas du bromure d'éthyle, le produit de réaction est principalement le produit de substitution. Lorsque l'encombrement stérique autour du centre électrophile augmente, comme c'est le cas pour le bromure d'isobutyle, la substitution est défavorisée et l'élimination est la réaction prédominante. D'autres facteurs favorisant l'élimination sont la force de la base. Avec le substrat benzoate moins basique, le bromure d'isopropyle réagit avec une substitution de 55%. En général, les réactions en phase gazeuse et les réactions de ce type en solution suivent les mêmes tendances, même si dans les premières, les effets des solvants sont abandonnés.
Mécanisme des ronds-points
Un développement qui a attiré l'attention en 2008 concerne un mécanisme de rond-point SN2 observé dans une réaction en phase gazeuse entre les ions chlorure et l'iodure de méthyle avec une technique spéciale appelée imagerie par faisceaux moléculaires croisés. Lorsque les ions chlorure ont une vitesse suffisante, l'énergie des ions iodure qui en résultent après la collision est beaucoup plus faible que prévu, et on suppose que l'énergie est perdue à la suite d'un détournement complet du groupe méthyle autour de l'atome d'iode avant que le déplacement réel n'ait lieu.
Pages connexes
- Réaction de substitution
- Réaction du SN1
Questions et réponses
Q : Qu'est-ce que la réaction SN2 ?
R : La réaction SN2 est une réaction de substitution en chimie organique, dans laquelle un nucléophile attaque un centre électrophile déficient en électrons, expulsant un groupe partant, puis le remplaçant en une seule étape.
Q : Quel type de réaction de substitution est la réaction SN2 ?
R : La réaction SN2 est un type de réaction de substitution nucléophile.
Q : Combien d'espèces réactives sont impliquées dans l'étape lente et déterminante de la réaction SN2 ?
R : Deux espèces réactives sont impliquées dans l'étape lente et déterminante de la réaction SN2.
Q : Que signifie le nom "substitution nucléophile bimoléculaire" pour la réaction SN2 ?
R : Le nom "substitution nucléophile bimoléculaire" pour la réaction SN2 fait référence au fait que deux espèces réactives sont impliquées dans l'étape lente et déterminante de la réaction.
Q : Qu'est-ce qu'un nucléophile dans le contexte de la réaction SN2 ?
R : Un nucléophile est une molécule ou un ion qui donne une paire d'électrons solitaire pour former une liaison chimique.
Q : Qu'est-ce qu'un électrophile dans le contexte de la réaction SN2 ?
R : Un électrophile est une molécule ou un ion qui accepte une paire d'électrons pour former une liaison chimique.
Q : Comment les chimistes inorganiques appellent-ils souvent la réaction SN2 ?
R : Chez les chimistes inorganiques, la réaction SN2 est souvent connue sous le nom de mécanisme d'échange.
Rechercher dans l'encyclopédie