SN1
La réaction SN1 est une réaction de substitution en chimie organique. "SN" signifie substitution nucléophile et le "1" représente le fait que l'étape de détermination de la vitesse n'implique qu'une seule molécule (unimoléculaire). La réaction implique un intermédiaire de carbocation. Certaines réactions SN1 courantes concernent des halogénures d'alkyle secondaires ou tertiaires dans des conditions fortement basiques ou, dans des conditions fortement acides, avec des alcools secondaires ou tertiaires. Avec les halogénures d'alkyle primaires, la réaction alternative SN2 se produit. Chez les chimistes inorganiques, la réaction SN1 est souvent connue comme le mécanisme de dissociation. Christopher Ingold et al. ont proposé le mécanisme de réaction pour la première fois en 1940.
Mécanisme
Un exemple de réaction se produisant avec un mécanisme de réaction SN1 est l'hydrolyse du bromure de tert-butyle avec de l'eau pour former de l'alcool tert-butylique :
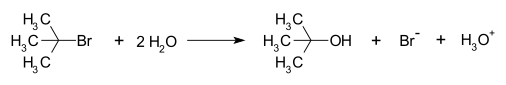
Cette réaction du SN1 se déroule en trois étapes :
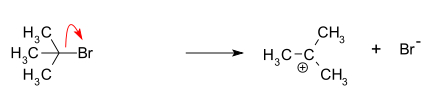
- Formation d'une carbocation tert-butyle par séparation d'un groupe partant (un anion bromure) de l'atome de carbone ; cette étape est lente et réversible.
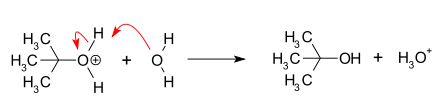
- Attaque nucléophile : la carbocation réagit avec le nucléophile. Si le nucléophile est une molécule neutre (c'est-à-dire un solvant), une troisième étape est nécessaire pour compléter la réaction. Lorsque le solvant est de l'eau, l'intermédiaire est un ion oxonium. Cette étape de réaction est rapide.

- Déprotonation : Élimination d'un proton sur le nucléophile protoné par l'eau agissant comme une base formant l'alcool et un ion hydronium. Cette étape de réaction est rapide.
Parce que la première étape est le goulot d'étranglement ou "étape de détermination de la vitesse", les chimistes classent l'ensemble du mécanisme de réaction comme SN1. Une seule molécule est nécessaire pour cette étape.
Portée de la réaction
Parfois, une molécule peut réagir en utilisant un mécanisme SN1 ou SN2. Le mécanisme SN1 gagnera cette compétition lorsque l'atome de carbone central est entouré de groupes volumineux, car ces groupes entravent stériquement la réaction SN2. De plus, les substituts volumineux sur le carbone central augmentent le taux de formation de carbocation en raison du soulagement de la contrainte stérique qui se produit. La carbocation qui en résulte est également stabilisée par la stabilisation inductive et l'hyperconjugaison des groupes alkyles attachés. Le postulat de Hammond-Leffler dit que cela aussi augmentera le taux de formation de la carbocation. Le mécanisme SN1 domine donc dans les réactions aux centres alkyles tertiaires et est en outre observé aux centres alkyles secondaires en présence de nucléophiles faibles.
Un exemple de réaction se déroulant selon le mode SN1 est la synthèse du 2,5-dichloro-2,5-diméthylhexane à partir du diol correspondant avec de l'acide chlorhydrique concentré :
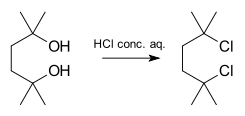
Au fur et à mesure que les substitutions alpha et bêta augmentent par rapport aux groupes sortants, la réaction est détournée du SN2 vers le SN1.
Stéréochimie
L'intermédiaire de carbocation formé lors de l'étape de limitation de la vitesse de la réaction est un carbone hybride sp2 à géométrie moléculaire plane trigonale. Cela permet deux voies différentes pour l'attaque nucléophile, une de chaque côté de la molécule plane. Si aucune des deux voies n'est privilégiée, elles seront utilisées de manière égale, ce qui donnera un mélange racémique d'énantiomères si la réaction a lieu dans un stéréocentre. Ceci est illustré ci-dessous dans la réaction SN1 du S-3-chloro-3-méthylhexane avec un ion iodure, qui donne un mélange racémique de 3-iodo-3-méthylhexane :
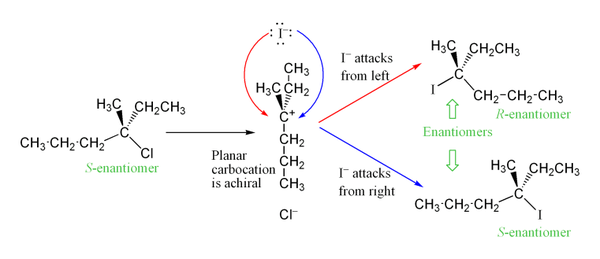
Cependant, un excès d'un stéréoisomère peut être observé, car le groupe sortant peut rester près de l'intermédiaire de carbocation pendant un court moment et bloquer l'attaque nucléophile. Ceci est très différent du mécanisme SN2, qui ne mélange pas la stéréochimie du produit (mécanisme stéréospécifique). Le mécanisme SN2 inverse toujours la stéréochimie de la molécule.
Réactions secondaires
Deux réactions secondaires courantes sont les réactions d'élimination et le réarrangement de la carbocation. Si la réaction se déroule dans des conditions chaudes ou d'échauffement (qui favorisent une augmentation de l'entropie), l'élimination E1 est susceptible de prédominer, entraînant la formation d'un alcène. À des températures plus basses, les réactions SN1 et E1 sont des réactions compétitives. Il devient donc difficile de favoriser l'une par rapport à l'autre. Même si la réaction est effectuée à froid, un certain alcène peut être formé. Si l'on tente d'effectuer une réaction SN1 en utilisant un nucléophile fortement basique tel que l'ion hydroxyde ou méthoxyde, l'alcène sera à nouveau formé, cette fois via une élimination E2. Cela sera particulièrement vrai si la réaction est chauffée. Enfin, si l'intermédiaire de carbocation peut se réarranger en une carbocation plus stable, il donnera un produit dérivé de la carbocation plus stable plutôt que le simple produit de substitution.
Effets des solvants
Les solvants modifient la vitesse de réaction. Comme la réaction SN1 implique la formation d'un intermédiaire de carbocation instable dans l'étape de détermination de la vitesse, tout ce qui peut y contribuer accélère la réaction. Les solvants normaux de choix sont à la fois polaires (pour stabiliser les intermédiaires ioniques en général) et protiques (pour solvater le groupe de départ en particulier). Les solvants protiques polaires typiques comprennent l'eau et les alcools, qui agiront également comme nucléophiles.
L'échelle Y met en corrélation les taux de réaction de solvolyse de tout solvant (k) avec celui d'un solvant standard (80% v/v éthanol/eau) (k0) par
log ( k k 0 ) = m Y {\displaystyle \log {\left({\frac {k}{k_{0}}}\right)}=mY\,}
avec m une constante de réactif (m = 1 pour le chlorure de tert-butyle),
- Y un paramètre de solvant, et
- k0 est la vitesse de réaction avec un solvant composé à 80% d'éthanol (mesurée en volume).
Par exemple, 100 % d'éthanol donne Y = -2,3, 50 % d'éthanol dans l'eau Y = +1,65 et 15 % de concentration Y = +3,2.
Questions et réponses
Q : Que signifie "SN" dans la réaction SN1 ?
R : "SN" signifie substitution nucléophile.
Q : Que représente "1" dans la réaction SN1 ?
R : "1" représente le fait que l'étape déterminant la vitesse n'implique qu'une seule molécule (unimoléculaire).
Q : Quel est le type de réaction SN1 ?
R : La réaction SN1 est une réaction de substitution.
Q : Quel est l'intermédiaire impliqué dans la réaction SN1 ?
R : La réaction SN1 implique un carbocation intermédiaire.
Q : Dans quelles conditions se produisent les réactions SN1 les plus courantes ?
R : Les réactions SN1 courantes se produisent avec des halogénures d'alkyle secondaires ou tertiaires dans des conditions fortement basiques, ou avec des alcools secondaires ou tertiaires dans des conditions fortement acides.
Q : Quelle réaction alternative se produit avec les halogénures d'alkyle primaires ?
R : Avec les halogénures d'alkyle primaires, la réaction alternative SN2 se produit.
Q : Qui a proposé pour la première fois le mécanisme de la réaction SN1 et en quelle année ?
R : Christopher Ingold et al. ont proposé pour la première fois le mécanisme de réaction SN1 en 1940.
Rechercher dans l'encyclopédie
