Repliement des protéines
Le repliement des protéines est le processus par lequel une protéine obtient sa forme fonctionnelle ou "conformation". Il s'agit principalement d'un processus d'auto-organisation. À partir d'une bobine aléatoire, les polypeptides se replient dans leur forme de travail caractéristique. La structure est maintenue ensemble par des liaisons hydrogène.
Les étapes sont :
- Chaque protéine existe sous la forme d'un polypeptide déplié ou d'une bobine aléatoire lorsqu'elle est traduite d'une séquence d'ARNm en une chaîne linéaire d'acides aminés. Ce polypeptide n'a pas de structure tridimensionnelle développée (côté gauche de la figure du haut).
- Les acides aminés interagissent entre eux pour produire une structure tridimensionnelle bien définie, la protéine repliée (à droite de la figure). C'est ce qu'on appelle l'état natif. La structure tridimensionnelle qui en résulte est déterminée par la séquence d'acides aminés (dogme d'Anfinsen).
Sans sa structure tridimensionnelle correcte, une protéine ne fonctionne pas. Cependant, certaines parties des protéines peuvent ne pas se replier : c'est normal.
Si les protéines ne se replient pas dans leur forme native, elles sont inactives et sont généralement toxiques. On pense que plusieurs maladies résultent de protéines mal repliées. De nombreuses allergies sont causées par le repliement des protéines, car le système immunitaire ne produit pas d'anticorps pour toutes les structures protéiques possibles.
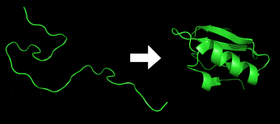
Protéines avant et après le pliage
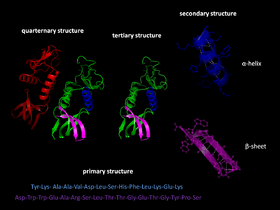
Le repliement des protéines est la troisième étape dans le développement de la structure des protéines.
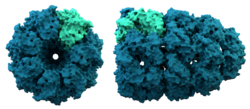
La structure d'un chaperonin. Les chaperonines aident au repliement de certaines protéines.
Chaperons
Les chaperonines sont de grandes protéines qui aident au repliement de certaines protéines après la synthèse. Les chaperons en général ont été découverts pour la première fois en aidant les histones et l'ADN à s'unir pour former des nucléosomes. Les nucléosomes sont les blocs de construction des chromosomes. Il est maintenant clair que c'est ainsi que de nombreux organites cellulaires se construisent.
Questions et réponses
Q : Qu'est-ce que le repliement des protéines ?
R : Le repliement des protéines est le processus par lequel une chaîne polypeptidique passe d'une chaîne linéaire dépliée d'acides aminés à sa forme tridimensionnelle caractéristique.
Q : Qu'est-ce qui maintient la structure ensemble ?
R : La structure d'une protéine pliée est maintenue par des liaisons hydrogène.
Q : Quelles sont les étapes du repliement des protéines ?
R : Les étapes du repliement des protéines comprennent un polypeptide déplié ou une bobine aléatoire lorsqu'il est traduit de l'ARNm en une chaîne linéaire d'acides aminés, qui interagissent ensuite entre eux pour produire une structure tridimensionnelle bien définie, connue sous le nom d'état natif.
Q : Que se passe-t-il si les protéines ne se replient pas correctement ?
R : Si les protéines ne se replient pas dans leur forme native, elles sont inactives et généralement toxiques. Cela peut entraîner plusieurs maladies et allergies causées par des protéines mal repliées que le système immunitaire ne reconnaît pas.
Q : Qui a résolu le problème du repliement des protéines en 2020 ?
R : Le 30 novembre 2020, le problème du repliement des protéines a été résolu par la société d'intelligence artificielle DeepMind.
Q : Qu'est-ce que le dogme d'Anfinsen ? R : Le dogme d'Anfinsen stipule que la structure tridimensionnelle résultante d'une protéine repliée est déterminée par sa séquence d'acides aminés.
Rechercher dans l'encyclopédie