Tableau périodique des éléments
Le tableau périodique des éléments chimiques est une liste des éléments chimiques connus. Dans le tableau, les éléments sont placés dans l'ordre de leur numéro atomique en commençant par le plus petit nombre de un, l'hydrogène. Le numéro atomique d'un élément est le même que le nombre de protons dans ce noyau particulier d'un atome. Dans le tableau périodique, les éléments sont disposés en périodes et en groupes. Une rangée d'éléments dans le tableau est appelée un point. Chaque période a un numéro ; de 1 à 8. La période 1 ne contient que deux éléments : l'hydrogène et l'hélium. La période 2 et la période 3 ont toutes deux 8 éléments. Les autres périodes sont plus longues. Les éléments d'un point ont des numéros atomiques consécutifs.
Une colonne d'éléments en bas du tableau est appelée un groupe. Il y a 18 groupes dans le tableau périodique standard. Chaque groupe a un numéro : de 1 à 18. Les éléments d'un groupe ont des électrons disposés de manière similaire, selon le nombre d'électrons de valence, ce qui leur donne des propriétés chimiques similaires (ils se comportent de manière similaire). Par exemple, le groupe 18 est connu sous le nom de "gaz rares" parce qu'ils sont tous des gaz et qu'ils ne se combinent pas avec d'autres atomes.
Il existe deux systèmes de numéros de groupe, l'un utilisant des chiffres arabes (1,2,3) et l'autre des chiffres romains (I, II, III). Les noms en chiffres romains ont été utilisés pendant la plus grande partie du 20e siècle. En 1990, l'Union internationale de chimie pure et appliquée (UICPA) a décidé d'utiliser le nouveau système avec des chiffres arabes, pour remplacer les deux anciens systèmes de groupes qui utilisaient des chiffres romains.
Le tableau périodique a été utilisé par les chimistes pour observer les modèles et les relations entre les éléments. Le tableau périodique comprend trois groupes principaux : les métaux, les métalloïdes et les non-métaux. Par exemple, les éléments en bas et à l'extrême gauche du tableau sont les plus métalliques, et les éléments en haut à droite sont les moins métalliques. (par exemple, le césium est beaucoup plus métallique que l'hélium). Il existe également de nombreux autres motifs et relations.
Le tableau périodique a été inventé par le chimiste russe Dmitry Ivanovich Mendeleyev (1834-1907). En son honneur, l'élément 101 a été nommé en son honneur, le mendélévium.
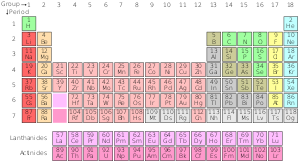
La variation standard du tableau périodique
Tableau périodique standard
| Groupe → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Période ↓ | ||||||||||||||||||||
| 1 | 1H | 2He | ||||||||||||||||||
| 2 | 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne | ||||||||||||
| 3 | 11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar | ||||||||||||
| 4 | 19K | 20Ca | 21Sc | 22Ti | 23V | 24Cr | 25Mn | 26Fe | 27Co | 28Ni | 29Cu | 30Zn | 31Ga | 32Ge | 33A | 34Se | 35Br | 36Kr | ||
| 5 | 37Rb | 38Sr | 39Y | 40Zr | 41Nb | 42Mo | 43Tc | 44Ru | 45Rh | 46Pd | 47Ag | 48Cd | 49En | 50Sn | 51Sb | 52Te | 53I | 54Xe | ||
| 6 | 55Cs | 56Ba | * Lanthanides | 72Hf | 73Ta | 74W | 75Re | 76Os | 77Ir | 78Pt | 79Au | 80Hg | 81Tl | 82Pb | 83Bi | 84Po | 85At | 86Rn | ||
| 7 | 87 | 88Ra | ** Actinides | 104Rf | 105Db | 106Sg | 107Bh | 108Hs | 109Mt | 110Ds | 111Rg | 112Cn | 113Nh | 114Fl | 115Mc | 116Lv | 117Ts | 118Og | ||
| 8 | 119 | 120 | *** Superactinides | |||||||||||||||||
| * Série Lanthanide | 57La | 58Ce | 59Pr | 60Nd | 61Pm | 62Sm | 63Eu | 64Gd | 65Tb | 66Dy | 67Ho | 68Er | 69Tm | 70Yb | 71Lu | |||||
| ** Série Actinide | 89Ac | 90e | 91Pa | 92U | 93Np | 94Pu | 95Am | 96Cm | 97Bk | 98Cf | 99E | 100Fm | 101Md | 102Non | 103Lr | |||||
| *** Série sur les superstitions | 121Ubu | 122Ubb | 123Ubt | 124Ubq | 125Ubp | 126Ubh | 127Ubs | 128Ubo | 129Ube | 130Utn | 131 | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Série sur les superstitions | 136Uème | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Série sur les superstitions | 151Upu | 152 | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Uhp | |||||
| *** Série sur les superstitions | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Utiliser | 180Uon | |||||
| *** Série sur les superstitions | 181Uou | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Série sur les superstitions | 196Ueh | 197Ues | 198Ueo | 199Uee | 200 milliards d'euros | 201Bnu | 202 milliards d'euros | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207 milliards | 208Bno | 209Bne | 210Bun | |||||
| *** Série sur les superstitions | 211Buu | 212Bub | 213 Mais | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220 milliards d'euros | 221Bbu | 222 | 223Bbt | 224Bbq | 225Bbp | |||||
Série chimique du tableau périodique
- Métaux alcalins
- Les terres alcalines
- Lanthanides
- Actinides
- Superactinides
- Métaux de transition
- Métaux pauvres
- Métalloïdes/Semi-métaux/Mi-métaux
- Non-métaux
- Halogènes
- Gaz nobles
Etat à température et pression standard. La couleur du nombre (numéro atomique) au-dessus du symbole de l'élément indique l'état de l'élément dans des conditions normales.
- ceux en bleu sont des gaz
- ceux en vert sont des liquides
- celles en noir sont solides
Radioactivité
- Ceux qui ont des frontières solides ont des isotopes stables (éléments primordiaux)
- Les frontières en pointillés ne contiennent que des isotopes radioactifs naturels
- Celles qui ont des bords en pointillés ne sont pas naturelles (éléments synthétiques)
- Ceux qui n'ont pas de frontières sont trop radioactifs pour avoir été découverts jusqu'à présent.
Autres méthodes d'affichage des éléments chimiques
La version du tableau périodique présentée ci-dessus est la plus utilisée. D'autres versions très répandues sont présentées ci-dessous :
· 
Theodor Benfey a disposé les éléments en spirale, autour de l'hydrogène. Le poids atomique détermine la position de l'élément.
· 
Dmitri Ivanovitch Mendeleïev a utilisé une composition florale ; les actinides et les lanthanides sont représentés en boucle à côté du groupe principal.
· 
Timothy Stove a classé les éléments par nombre quantique.
· ![]()
Betterman a arrangé les éléments selon leurs propriétés isoélectriques, qui peuvent être converties en une forme polynomiale.
· 
Version triangulaire, par Zmaczynski et Bayley
· 
Disposés en pyramide.
Versions moins utilisées
- Le tableau standard fournit les éléments de base. Il est présenté ci-dessus
- Un tableau vertical pour une meilleure lisibilité dans les navigateurs web
- Le grand tableau fournit les éléments de base ainsi que les noms complets des éléments
- L'immense tableau fournit les éléments de base ainsi que les noms complets des éléments et les masses atomiques
- Configurations des électrons
- Métaux et non-métaux
- Liste des éléments : comprend le nom, le symbole, le numéro atomique, la masse atomique, le groupe et la période ; triable par l'un de ces éléments
- Liste des éléments par symbole
- Liste des éléments par point d'ébullition
- Liste des éléments par point de fusion
- Liste des éléments par densité
Pages connexes
- Groupe de tableaux périodiques
- Période du tableau périodique
- Tableau périodique étendu
Questions et réponses
Q : Qu'est-ce que le tableau périodique ?
R : Le tableau périodique est un tableau qui classe tous les éléments chimiques connus dans l'ordre de leur numéro atomique, en commençant par l'hydrogène. Les éléments présentant des caractéristiques similaires sont souvent placés les uns à côté des autres.
Q : Combien de périodes et de groupes le tableau périodique standard comporte-t-il ?
R : Le tableau périodique standard comporte 8 périodes et 18 groupes.
Q : Qu'est-ce que les éléments d'une période ont en commun ?
R : Les éléments d'une période ont des numéros atomiques consécutifs.
Q : Qu'ont en commun les éléments d'un groupe ?
R : Les éléments d'un groupe ont des électrons disposés de la même manière, selon le nombre d'électrons de valence, ce qui leur confère des propriétés chimiques similaires.
Q : Qui a inventé le tableau périodique ?
R : Le chimiste russe Dmitri Ivanovitch Mendeleïev a inventé le tableau périodique (1834-1907).
Q : Quels sont les trois principaux groupes du tableau périodique ?
R : Les trois principaux groupes du tableau périodique sont les métaux, les métalloïdes et les non-métaux.
Q : Comment peut-on observer les schémas et les relations entre les éléments à l'aide du tableau périodique ?
R : On peut observer des schémas et des relations entre les éléments en regardant où ils apparaissent dans le tableau périodique ; par exemple, les éléments situés en bas à gauche du tableau ont tendance à être plus métalliques que ceux situés en haut à droite.
Rechercher dans l'encyclopédie