Théorie atomique
En chimie et en physique, la théorie atomique explique comment notre compréhension de l'atome a évolué au fil du temps. On pensait autrefois que les atomes étaient les plus petits morceaux de matière. Cependant, on sait aujourd'hui que les atomes sont constitués de protons, de neutrons et d'électrons. Ces particules subatomiques sont composées de quarks. La première idée de l'atome est venue du philosophe grec Démocrite. Une grande partie des idées de la théorie moderne vient de John Dalton, un chimiste et physicien britannique.
La théorie s'applique aux solides, aux liquides et aux gaz, mais elle ne s'applique pas de manière analogue aux plasmas ou aux étoiles à neutrons.

Démocrite était un philosophe grec, 460 av.

Roger Joseph Boscovich. Un jésuite croate qui a fourni un prototype de la théorie atomique

John Dalton (1766-1844), chimiste et physicien anglais
Sir Joseph John Thomson (1856-1940), physicien anglais, a découvert l'électron et sa charge négative. Il a reçu le prix Nobel de physique
La théorie atomique de Démocrite
Démocrite pensait que si l'on coupe quelque chose en deux encore et encore, il faudrait enfin s'arrêter. Il a dit que ce dernier morceau de matière ne pouvait pas être coupé plus petit. Démocrite a appelé ces petits morceaux de matière des atomes, ce qui signifie "indivisible". Il pensait que les atomes dureraient éternellement, ne changeraient jamais et ne pourraient pas être détruits. Démocrite pensait qu'il n'y avait rien entre les atomes et que tout ce qui nous entourait pouvait s'expliquer si nous comprenions comment les atomes fonctionnaient.
D'autres philosophes étaient d'accord, d'autres pas. Ils n'avaient aucun moyen d'expérimenter pour montrer si sa théorie était vraie ou non.
La théorie atomique de Boscovich
En 1758, Roger Joseph Boscovich a décrit un précurseur de la théorie atomique.
La théorie atomique de Dalton
En 1803, le scientifique anglais John Dalton, né à Cumberland, a retravaillé la théorie de Démocrite, comme suit :
- Toute la matière est formée d'atomes.
- Que les atomes sont des particules indivisibles et invisibles.
- Que les atomes d'un même élément sont de même type et de même masse.
- Les atomes qui composent les composés chimiques sont présents dans des proportions déterminées.
- Les changements chimiques correspondent à une réorganisation des atomes participant à la réaction chimique.
Dalton a défini l'atome comme l'unité de base d'un élément qui peut participer à une combinaison chimique.
Le modèle atomique de Thomson
En 1850, Sir William Crookes a construit un "tube à décharge", c'est-à-dire un tube en verre dont l'air est évacué et dont les extrémités sont munies d'électrodes métalliques, relié à une source de haute tension. En créant un vide dans le tube, on peut observer une légère décharge qui va de la cathode (électrode chargée négativement) à l'anode (électrode chargée positivement). Les escrocs ont baptisé cette émission "rayons cathodiques".
Après les expériences sur les rayons cathodiques, Sir Joseph John Thomson a établi que le rayon émis était formé par des charges négatives, parce qu'elles étaient attirées par le pôle positif. Thomson savait que les atomes étaient électriquement neutres, mais il a établi que, pour que cela se produise, un atome devait avoir la même quantité de charges négatives et positives. Les charges négatives ont été appelées électrons (e-).
Selon les hypothèses établies sur la charge neutre des atomes, Thomson a proposé le premier modèle atomique, décrit comme une sphère chargée positivement dans laquelle les électrons sont incrustés (avec des charges négatives). Ce modèle est connu sous le nom de modèle du plum-pudding.
En 1906, Robert Millikan a déterminé que les électrons avaient une charge de Coulomb (C) de -1,6 * 10-19, ce qui permettait de calculer sa masse comme étant minuscule, égale à 9,109 * 10-31 kg.
Dans le même temps, les expériences menées par Eugene Goldstein en 1886 avec des tubes à décharge cathodique lui ont permis d'établir que les charges positives avaient une masse de 1,6726 * 10-27 kg et une charge électrique de +1,6 * 10 -19 C. Lord Ernest Rutherford a ensuite nommé ces particules chargées positivement des protons

Représentation schématique du modèle Thomson.
Le modèle atomique de Rutherford
En 1910, le physicien néo-zélandais Ernest Rutherford a avancé l'idée que les charges positives de l'atome se trouvaient principalement en son centre, dans le noyau, et les électrons (e-) autour de lui.
Rutherford l'a montré en utilisant une source de rayonnement alpha (provenant de l'hélium) pour frapper les très fines feuilles d'or, entourées d'un abat-jour en sulfure de zinc qui produisait de la lumière visible lorsqu'il était frappé par des émissions alpha. Cette expérience a été appelée l'expérience Geiger-Marsden ou l'expérience des feuilles d'or
À ce stade, les principaux éléments de l'atome étaient clairs, plus la découverte que les atomes d'un élément peuvent se trouver dans des isotopes. Le nombre de neutrons présents dans le noyau varie selon les isotopes. Bien que ce modèle ait été bien compris, la physique moderne s'est encore développée et les idées actuelles ne peuvent être rendues faciles à comprendre. Vous trouverez quelques idées sur la physique atomique actuelle dans les liens du tableau ci-dessous.
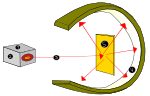
Expérience atomique de Lord Ernest Rutherford
La physique moderne
Les atomes ne sont pas des particules élémentaires, car ils sont constitués de particules subatomiques comme les protons et les neutrons. Les protons et les neutrons ne sont pas non plus des particules élémentaires, car ils sont constitués de particules encore plus petites appelées quarks, reliées entre elles par d'autres particules appelées gluons (parce qu'elles "collent" les quarks entre eux dans l'atome). Les quarks sont élémentaires parce que les quarks ne peuvent pas être décomposés davantage.
Questions et réponses
K: Mikä on atomiteoria?
V: Atomiteoria selittää, miten käsityksemme atomista on muuttunut ajan myötä.
K: Mitä atomien ajateltiin aikoinaan olevan?
V: Atomien ajateltiin aikoinaan olevan aineen pienimpiä palasia.
K: Mistä atomit itse asiassa koostuvat?
V: Atomit koostuvat protoneista, neutroneista ja elektroneista.
K: Mistä subatomiset hiukkaset koostuvat?
V: Subatomiset hiukkaset koostuvat kvarkkeista.
K: Kuka kreikkalainen filosofi keksi ensimmäisenä ajatuksen atomista?
V: Ensimmäinen ajatus atomista tuli kreikkalaiselta filosofilta Demokritukselta.
K: Kuka on brittiläinen kemisti ja fyysikko, joka antoi monia ideoita moderniin teoriaan?
V: John Dalton, brittiläinen kemisti ja fyysikko, antoi monia ideoita moderniin teoriaan.
K: Sovelletaanko atomiteoriaa plasmoihin tai neutronitähtiin?
V: Teoriaa sovelletaan kiinteisiin aineisiin, nesteisiin ja kaasuihin, mutta sitä ei sovelleta plasmoihin tai neutronitähtiin vastaavalla tavalla.
Rechercher dans l'encyclopédie