Isotopes de l'hydrogène
L'hydrogène a trois isotopes principaux : le protium (1H), le deutérium (2H) et le tritium (3H). Ces isotopes se forment naturellement dans la nature. Le protium et le deutérium sont stables. Le tritium est radioactif et a une demi-vie d'environ 12 ans. Les scientifiques ont créé quatre autres isotopes de l'hydrogène (4H à 7H), mais ces isotopes sont très instables et n'existent pas dans la nature.
Les principaux isotopes de l'hydrogène sont uniques car ils sont les seuls à avoir un nom. Ces noms sont encore utilisés aujourd'hui. Le deutérium et le tritium ont parfois leurs propres symboles, D et T. Cependant, l'Union internationale de chimie pure et appliquée n'aime pas beaucoup ces noms, même s'ils sont souvent utilisés. D'autres isotopes avaient leur propre nom lorsque les scientifiques étudiaient la radioactivité. Mais, leurs noms ne sont plus utilisés aujourd'hui.
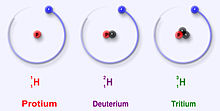
Les trois isotopes les plus stables de l'hydrogène
Protium (hydrogène-1)
Le protium est l'isotope le plus courant de l'hydrogène. Il représente plus de 99,98 % de tout l'hydrogène de l'univers. Il est appelé protium parce que son noyau ne contient qu'un seul proton. Le protium a une masse atomique de 1,00782504(7) u. Le symbole du protium est 1H.
Le proton du protium n'a jamais subi de désintégration dans une observation, c'est pourquoi les scientifiques pensent que le protium est un isotope stable. Les nouvelles théories de la physique des particules prédisent qu'un proton peut se décomposer, mais cette décomposition est très lente. On dit que le proton a une demi-vie de 1036 ans. Si la désintégration du proton est vraie, alors tous les autres noyaux que l'on dit stables ne le sont en fait que par observation, c'est-à-dire qu'ils semblent stables. Des expériences récentes ont montré que si la désintégration des protons se produit, elle aurait une demi-vie de 6,6 × 1033 ans.
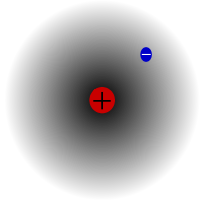
Le protium, l'isotope le plus commun de l'hydrogène. Il est spécial car c'est le seul isotope qui n'a pas de neutron.
Deutérium (hydrogène-2)
Le deutérium, ou 2H ou parfois D, est un autre isotope stable de l'hydrogène. L'isotope a un proton et un neutron. Il représente environ 0,0026 à 0,0184 % de tous les atomes d'hydrogène sur Terre. Le deutérium est moins présent dans l'hydrogène gazeux sur Terre et plus présent dans l'eau de mer (0,015 % ou 150 ppm). Le deutérium n'est pas radioactif et ne nuit pas aux êtres vivants. Le deutérium peut également former des molécules d'eau. L'eau qui contient du deutérium au lieu de protium est appelée eau lourde.
Tritium (hydrogène-3)
Le tritium (3H) est le radio-isotope le plus stable de l'hydrogène. C'est-à-dire que, de tous les isotopes radioactifs de l'hydrogène, le tritium est le moins radioactif. Il possède un proton et 2 neutrons dans son noyau. Le tritium se désintègre par désintégration bêta moins et se transforme en hélium 3. Il a une demi-vie de 12,32 ans.
Le tritium est formé naturellement par l'interaction entre les gaz de la haute atmosphère et les rayons cosmiques. Il est également créé lors des essais d'armes nucléaires. Le tritium et le deutérium sont utilisés dans la fusion nucléaire D-T dans les étoiles pour produire beaucoup d'énergie.
Questions et réponses
Q : Combien existe-t-il d'isotopes principaux de l'hydrogène ?
R : Il existe trois isotopes principaux de l'hydrogène : le protium, le deutérium et le tritium.
Q : Le protium et le deutérium sont-ils des isotopes stables ?
R : Oui, le protium et le deutérium sont des isotopes stables.
Q : Quelle est la demi-vie du tritium ?
R : Le tritium est radioactif et a une demi-vie d'environ 12 ans.
Q : Combien d'autres isotopes de l'hydrogène les scientifiques ont-ils créés ?
R : Les scientifiques ont créé quatre autres isotopes de l'hydrogène : 4H à 7H.
Q : Ces quatre autres isotopes de l'hydrogène existent-ils à l'état naturel ?
R : Non, ces isotopes sont très instables et n'existent pas à l'état naturel.
Q : Qu'est-ce qui rend les principaux isotopes de l'hydrogène uniques ?
R : Les principaux isotopes de l'hydrogène sont uniques parce qu'ils sont les seuls à porter un nom.
Q : Le deutérium et le tritium ont-ils leurs propres symboles ?
R : Oui, le deutérium et le tritium ont parfois leurs propres symboles : Cependant, l'Union internationale de chimie pure et appliquée n'aime pas beaucoup ces noms, même s'ils sont souvent utilisés.
Rechercher dans l'encyclopédie