Principe isolobal
Le principe isolobal (également connu sous le nom d'analogie isolobale) permet de prédire les propriétés de liaison des composés organométalliques. En chimie organométallique, il met en relation la structure des ligands organiques qui peuvent se lier à des fragments moléculaires inorganiques. Roald Hoffmann a décrit les fragments moléculaires comme étant isolobaux "si le nombre, les propriétés de symétrie, l'énergie approximative et la forme des orbitales frontières et le nombre d'électrons qu'elles contiennent sont similaires - pas identiques, mais similaires". On peut prédire la liaison et la réactivité d'une pièce moins connue par rapport à celles d'une pièce mieux connue si les deux fragments moléculaires ont des orbitales frontières similaires, l'orbitale moléculaire occupée la plus haute (HOMO) et l'orbitale moléculaire inoccupée la plus basse (LUMO). Les composés isolobes sont des analogues des composés isoélectroniques qui partagent le même nombre d'électrons de valence et la même structure. Une représentation graphique des structures isolobales, avec les paires d'isolobes reliées par une flèche à double tête et une demi-orbitale en dessous, se trouve sur la figure 1.
Pour ses travaux sur l'analogie isolobale, Hoffmann a reçu le prix Nobel de chimie en 1981, qu'il a partagé avec Kenichi Fukui. Dans sa conférence de remise du prix Nobel, Hoffmann a souligné que l'analogie isolobale est un modèle utile, mais simple. Elle échoue dans certains cas.
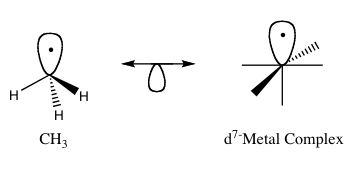
Figure 1 : Exemple de base de l'analogie isolobale.
Questions et réponses
Q : Qu'est-ce que le principe de l'isolobal ?
R : Le principe isolobal (également connu sous le nom d'analogie isolobal) est un moyen de prédire les propriétés de liaison des composés organométalliques. Il met en relation la structure des ligands organiques qui peuvent se lier à des fragments moléculaires inorganiques en comparant leur orbitale moléculaire occupée la plus élevée (HOMO) et leur orbitale moléculaire inoccupée la plus basse (LUMO).
Q : Qui a proposé le principe de l'isolobal ?
R : Roald Hoffmann a proposé le principe de l'isolobal.
Q : Quel est le rapport avec les composés isoélectroniques ?
R : Les composés isolobal sont des analogues des composés iso-électroniques qui partagent le même nombre d'électrons de valence et la même structure.
Q : Qu'a reçu Hoffmann pour son travail sur ce concept ?
R : Pour son travail sur l'analogie isolobal, Hoffmann a reçu le prix Nobel de chimie en 1981, qu'il a partagé avec Kenichi Fukui.
Q : Comment Hoffmann a-t-il décrit les fragments moléculaires ?
R : Hoffmann décrivait les fragments moléculaires comme isolobal "si le nombre, les propriétés de symétrie, l'énergie approximative et la forme des orbitales frontières et le nombre d'électrons qu'elles contiennent sont similaires - pas identiques, mais similaires."
Q : Comment utilise-t-on ce modèle pour prédire la liaison et la réactivité ?
R : On peut prédire la liaison et la réactivité d'une pièce moins connue à partir de celle d'une pièce mieux connue si elles ont des orbitales frontières similaires.
Q : Ce modèle fonctionne-t-il toujours correctement ?
R : Non, il échoue dans certains cas.
Rechercher dans l'encyclopédie