Calorimétrie différentielle à balayage
La calorimétrie différentielle à balayage (DSC), est un outil d'analyse largement utilisé dans les sciences des matériaux, la thermochimie, la pureté des médicaments et les tests de qualité des aliments. Sa rapidité et sa facilité d'utilisation donnent des informations instantanées sur les caractéristiques thermodynamiques qui jouent un rôle important dans la compréhension des processus complexes au cours de la formation des substances ; par exemple, la réticulation des polymères, l'échange de chaleur dû au pliage et au dépliage des protéines ou le mécanisme de formation de l'ADN simple ou double brin. La DSC a été inventée pour la première fois en 1962 par E.S. Watson et M.J. O'Neil et a été mise sur le marché en 1963 lors de la conférence sur la chimie analytique et la spectroscopie appliquée qui s'est tenue à Pittsburgh.
Structure physique
Les deux types de calorimètre à balayage différentiel les plus courants sont le DSC à flux de chaleur, qui fonctionne en maintenant constante l'alimentation en chaleur du système, et le DSC à compensation de puissance, qui fonctionne en maintenant constante l'alimentation en puissance du calorimètre. En général, un DSC calcule les changements de chaleur en mesurant la différence de température entre l'échantillon et le support de référence. La conception typique du DSC de flux de chaleur est illustrée par la figure 1. Elle contient le porte-échantillon, où est placé le matériau d'intérêt, et le porte-référence, qui est généralement maintenu vide. Ces deux éléments sont placés sur un support, qui est en bon contact avec les parois du calorimètre. La résistance chauffante est fixée aux parois de l'enceinte, ce qui permet d'obtenir un four qui génère et maintient la quantité de chaleur nécessaire à l'intérieur de l'enceinte. Le thermocouple connecté à la fois à l'échantillon et au support de référence est un appareil de mesure qui donne la température à utiliser dans l'analyse. La chaleur fournie par la résistance chauffante s'écoule ensuite dans les chambres de l'échantillon et des matériaux de référence.
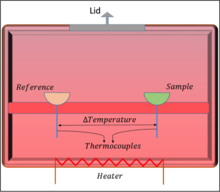
Figure 1. Schéma de la Calorimétrie Différentielle à Balayage à Flux de Chaleur.
Théorie
L'approche théorique la plus simple pour comprendre le mécanisme de fonctionnement des CSD est appelée le modèle linéaire simplifié et fait appel aux hypothèses suivantes :
- Le débit de chaleur est constant,
- Aucune interaction entre l'échantillon et la référence,
- Seules les capacités thermiques de l'échantillon et de la référence sont prises en compte,
- La température mesurée est la température actuelle de l'échantillon,
- Le système est isolé de l'environnement, c'est-à-dire qu'il n'y a pas d'échange de chaleur avec l'extérieur.
La loi de Fourier sur la conduction de la chaleur, qui est la loi fondamentale expliquant comment la chaleur est transférée à travers les matériaux, peut être utilisée pour voir la relation entre la température et le flux de chaleur dans le système. Cette loi stipule que la quantité d'énergie thermique passant à travers une petite partie d'une zone (A) d'un matériau, appelée densité de flux thermique et désignée par ( Φ A ) {\textstyle ({\frac {\mathsf {\Phi }}{\mathsf {A}}})},

k{\frac {{\mathsf {\Delta }}T}{\mathsf {\Delta}}x}}}}
En général, dans le DSC, un ordinateur est utilisé pour fournir de la chaleur à un taux spécifique dans les supports de référence et d'échantillon. Lorsque le porte-échantillon contient une substance alors que la référence reste vide, la température du porte-échantillon augmente ou diminue (T s)
- Si le processus consomme de la chaleur, c'est-à-dire que de la chaleur externe est nécessaire pour que l'événement ait lieu, ce qui est également appelé endothermique, alors la température dans le porte-échantillon diminue.
- Si le processus libère de la chaleur, c'est-à-dire que de la chaleur supplémentaire est produite, ce qui est également appelé exothermique, alors la température dans le porte-échantillon augmente.
Ensuite, la modification du flux thermique résultant de ces variations de température peut être trouvée en utilisant la loi de Fourier comme suit,
| Φ r | = k A Δ x | Δ T s r | {\displaystyle |{\mathsf {\Phi }}_{r}|={\frac {kA}{{\mathsf {\Delta }}x}}|{\mathsf {\Delta}}T_{sr}|}
ou
| Φ r | = K | Δ T s r | = { - K Δ T s r , : exothermique K Δ T s r , : endothermique {\displaystyle |{\mathsf {\Phi }}_{r}|=K|{\mathsf {\Delta }}T_{sr}|={\begin{cases}-K{\mathsf {\Delta }}}T_{sr},&{\text{ : exothermique}}\\K{\mathsf {\Delta }}T_{sr},&{\text{ : endothermique}}}\end{cases}}
Ainsi, sur la base de ce modèle simple, il s'avère qu'il y a une proportionnalité directe (K) entre le flux de chaleur et les variations de température de l'échantillon. Cette constante de proportionnalité dépend de la distance entre la paroi et l'échantillon indiquée (Δx), de la section transversale du support (A) et de la conductivité thermique (k). En général, les principaux résultats de l'expérience DSC sont un signal de sortie du débit de chaleur en fonction de la température, que l'on appelle les courbes DSC. L'analyse de ces courbes joue un rôle important dans la détermination de la chaleur de transformation, de la chaleur de réaction ou de toute modification de la capacité thermique due aux variations de température. Par exemple, l'enthalpie des processus exothermiques et endothermiques peut être déterminée en trouvant l'aire sous la courbe DSC à l'aide d'une technique mathématique appelée calcul intégral.
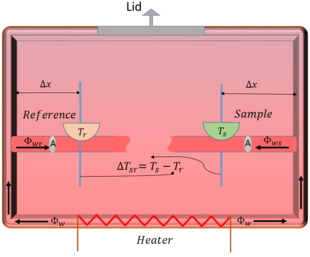
Figure 2 : Le dessin schématique avec toutes les variables affectées à l'analyse théorique.
Demandes
Dénaturation thermique des protéines
L'une des applications les plus importantes du DCS est liée au déploiement thermique des protéines, un processus appelé dénaturation. Le rôle du DCS dans ce processus est utilisé pour déterminer la plage de température sur laquelle les protéines présentent des changements structurels. En outre, lorsque la solution de protéines est traitée à un taux de chaleur constant et à une pression constante, le DSC peut déterminer les capacités thermiques apparentes des protéines. En fait, les protéines dénaturées s'avèrent avoir des capacités thermiques plus élevées et une détection adéquate des changements qu'elles subissent au fil du temps peut aider à déterminer l'ampleur du déploiement.
Évaluation des lipides et des graisses
Le contrôle de la qualité des aliments est l'une des questions les plus importantes pour les soins de santé et le bien-être de l'homme. De nombreuses pratiques illégales ont été signalées en ce qui concerne les produits alimentaires, notamment la falsification de certaines huiles et graisses végétales très chères. L'adultération est une action consistant à mélanger des ingrédients de mauvaise qualité et parfois nocifs avec des produits alimentaires destinés à être vendus. Dans ce domaine, la DSC est utilisée pour analyser le comportement thermique des lipides principalement par deux procédés, le procédé de refroidissement, qui rapporte des informations sur la cristallisation et le procédé de chauffage, qui donne des informations sur le comportement de fusion des éléments constitutifs des lipides. L'adultération dans les graisses ou les huiles modifie les courbes de refroidissement et de chauffage de la DSC. Par exemple, de nouveaux pics apparaissent et les pics existants subissent des modifications. Par conséquent, l'analyse des données DSC peut être utilisée pour estimer le processus d'adultération des nutriments.
Pureté des drogues
La DSC a suscité beaucoup d'intérêt pour l'étude de la pureté des médicaments car elle nécessite des échantillons en faible quantité (1-2 mg) et est considérablement rapide en termes de temps d'analyse. Par exemple, en surveillant les effets des substances étrangères, il est possible de déterminer dans quelle mesure une drogue est pure. Il s'avère que les impuretés diminuent la température de fusion ( T m )/style d'affichage (T_{m})}

Questions et réponses
Q : Qu'est-ce que la calorimétrie différentielle à balayage ?
R : La calorimétrie différentielle à balayage (DSC) est un outil d'analyse largement utilisé dans les sciences des matériaux, la thermochimie, les tests de pureté des médicaments et de qualité des aliments.
Q : Quel type d'informations la DSC fournit-elle ?
R : La DSC fournit des informations instantanées sur les caractéristiques thermodynamiques qui jouent un rôle important dans la compréhension des processus complexes au cours de la formation des substances.
Q : Dans quels domaines la DSC peut-elle être appliquée ?
R : La DSC peut être utilisée dans les sciences des matériaux, la thermochimie, les tests de pureté des médicaments et de qualité des aliments.
Q : Qui a inventé la DSC ?
R : La DSC a été inventée par E.S. Watson et M.J. O'Neil en 1962.
Q : Quand la DSC a-t-elle été mise sur le marché ?
R : La DSC a été mise sur le marché en 1963 lors de la conférence sur la chimie analytique et la spectroscopie appliquée qui s'est tenue à Pittsburgh.
Q : Quels sont les exemples de processus complexes que la DSC peut aider à comprendre ?
R : Par exemple, la DSC peut aider à comprendre la réticulation des polymères, l'échange de chaleur dû au pliage et au dépliage des protéines ou le mécanisme de formation de l'ADN simple ou double brin.
Q : Quels sont les avantages de la DSC ?
R : Parmi les avantages de la DSC, on peut citer sa rapidité et sa facilité d'utilisation, qui permettent d'obtenir des informations instantanées sur les caractéristiques thermodynamiques.
Rechercher dans l'encyclopédie


