Les réactions chélétropiques
Les réactions chélétropiques sont un type de réaction péricyclique où un atome sur un des réactifs obtient deux nouvelles liaisons. Une réaction péricyclique est une réaction qui implique un état de transition avec un réseau cyclique d'atomes et un réseau cyclique associé d'orbitales en interaction. Une réorganisation des liaisons σ et π se produit dans ce réseau cyclique.
Les réactions chimiothérapiques sont une sous-classe des cycloadditions. Ce qui distingue les réactions chélétropes, c'est que sur l'un des réactifs, les deux nouvelles liaisons sont faites au même atome. Quelques exemples sont présentés à droite sur la figure 1. Dans le premier cas, l'atome unique est l'atome de carbone du groupe carbonyle. Cet atome de carbone se retrouve dans le monoxyde de carbone. Le résultat final est la création de deux nouvelles liaisons à un atome. Les deux premiers exemples sont connus sous le nom d'"extrusions chélétropes" car une petite molécule stable est libérée dans la réaction. La force motrice de ces réactions est souvent l'avantage entropique de la libération d'un gaz (par exemple, CO ou N2).

Figure 1. Réactions péricycliques
Analyse théorique
En raison de la géométrie des molécules impliquées dans les réactions chélétropes, elles confirment un certain nombre de prédictions faites par les chimistes théoriciens. Les réactions chélétropes confirment la conservation de la symétrie des orbites moléculaires.
Dans l'état de transition péricyclique, une petite molécule donne deux électrons à l'anneau. Deux géométries possibles peuvent expliquer la réaction. La petite molécule peut s'approcher de façon linéaire ou non linéaire. Dans l'approche linéaire, les électrons dans l'orbite de la petite molécule sont dirigés directement vers le système π de la grande molécule. Dans l'approche non linéaire, l'orbite s'approche avec un angle légèrement décalé. La capacité du système π à tourner à l'approche de la petite molécule est cruciale pour la formation de nouvelles liaisons. Le sens de la rotation sera différent selon le nombre d'électrons de π dans le système. Le schéma ci-dessous montre un fragment de deux électrons s'approchant d'un système π à quatre électrons en utilisant des orbitales moléculaires de frontière. La rotation sera disrotative si la petite molécule s'approche de manière linéaire et conrotative si la molécule s'approche de manière non linéaire. La rotation et la conrotation indiquent comment les liaisons dans le système π tournent. La disrotatoire signifie des directions opposées tandis que la conrotatoire signifie la même direction. Ceci est également illustré dans le diagramme ci-dessous.
En utilisant la règle de Huckel, on peut dire si le système π est aromatique ou anti-aromatique. S'il est aromatique, les approches linéaires utilisent un mouvement disrotatif tandis que les approches non linéaires utilisent un mouvement conrotatif. L'inverse est vrai pour un système anti-aromatique. Les approches linéaires auront un mouvement conrotatif tandis que les approches non linéaires auront un mouvement disrotatif.
Réactions chimiothérapiques impliquant le SO2
Thermodynamique
Lorsque le dioxyde de soufre réagit avec le butadiène et l'isoprène, il en résulte deux produits différents. Le mécanisme de réaction contrôlera ce qui sera fabriqué. Un produit cinétique et un produit thermodynamique sont tous deux possibles. Le produit thermodynamique est plus important que le produit cinétique. Le produit cinétique provient d'une réaction de Diels-Alder, tandis qu'une réaction chélétropique donne un produit thermodynamiquement plus stable. La voie chélétropique est davantage utilisée car elle donne un produit d'addition cyclique à cinq membres plus stable. Le schéma ci-dessous montre la différence entre les deux produits. Le chemin vers la gauche montre le produit thermodynamique, tandis que le chemin vers la droite montre le produit cinétique. Suarez et Sordo l'ont montré en 1995. Ils l'ont montré à la fois par des expériences et en utilisant des calculs gaussiens.
Cinétique
Un exemple en est les réactions chélétropes des 1,3-diènes avec le dioxyde de soufre. Les chimistes ont étudié avec soin la cinétique de cette réaction. En 1976, Isaacs et Laila ont mesuré les facteurs cinétiques de l'addition de dioxyde de soufre aux dérivés du butadiène. Les taux d'addition ont été contrôlés dans du benzène à 30 °C avec un excès initial de diène vingt fois supérieur. Ils ont utilisé un spectrophotomètre pour étudier la lumière à 320 nm afin de mesurer la disparition du SO2. La réaction a montré une "pseudo-cinétique du premier ordre". Les chimistes ont découvert que les groupes attracteurs d'électrons sur le diène diminuaient la vitesse de réaction. De plus, la vitesse de réaction a été considérablement affectée par les effets stériques des substituts 2, des groupes plus volumineux augmentant la vitesse de réaction. (En d'autres termes, plus le groupe d'atomes accrochés au second atome de carbone est grand, plus la réaction est rapide). Les auteurs attribuent cela à la tendance des groupes volumineux à favoriser la conformation cisoïde du diène qui est essentielle à la réaction (voir tableau ci-dessous). En outre, les taux à quatre températures ont été mesurés pour sept des diènes. À partir de ces mesures, les chimistes ont utilisé l'équation d'Arrhenius pour calculer l'enthalpie d'activation (ΔH‡) et l'entropie d'activation (ΔS‡) pour chaque réaction. Ce fut l'un des premiers efforts importants pour étudier la génétique d'une réaction chélétropique.
| -Butadiène | 104 k /min-1 (30 °C) (± 1-2%) absolu | 104 k /min-1 (30 °C) (± 1-2%) relatif | ΔH‡ /kcal mol-1 | ΔS‡ /cal mol-1 K-1 |
| 2-méthyle | 1.83 | 1.00 | 14.9 | -15 |
| 2-éthyle | 4.76 | 2.60 | 10.6 | -20 |
| 2-isopropyle | 13.0 | 7.38 | 12.5 | -17 |
| 2-tert-butyl | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentyl | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N/A | N/A |
| 2-bromoéthyle | 0.72 | 0.39 | N/A | N/A |
| 2-p-tolyl | 24.7 | 13.5 | 10.4 | -19 |
| 2-phényle | 17.3 | 9.45 | N/A | N/A |
| 2-(p-bromophényle) | 9.07 | 4.96 | N/A | N/A |
| 2,3-diméthyle | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-méthyle | 0.18 | 0.10 | N/A | N/A |
| trans-1-méthyle | 0.69 | 0.38 | N/A | N/A |
| 1,2-diméthylène-cyclohexane | 24.7 | 13.5 | 11.4 | -16 |
| 2-méthyl-1,1,4,4-d4 | 1.96 | N/A | N/A | N/A |
En 2002, Monnat, Vogel et Sordo ont mesuré la cinétique d'addition du dioxyde de soufre aux 1,2-diméthylidènecycloalcanes. Ils ont écrit que la réaction du 1,2-diméthylidènecyclohexane avec le dioxyde de soufre peut donner deux produits différents en fonction des conditions de réaction. La réaction donne la sultine correspondante par une réaction d'hétéro-Diels-Alder sous contrôle cinétique (≤ -60 °C), mais, sous contrôle thermodynamique (≥ -40 °C), la réaction donne le sulfolène correspondant par une réaction chélétropique. L'enthalpie d'activation de la réaction hétéro-Diels-Alder est inférieure d'environ 2 kcal/mol à celle de la réaction chélétrophique correspondante. Le sulfolène est environ 10 kcal/mol plus stable que la sultine isométrique en solution de CH2Cl2/SO2.
Les auteurs ont pu élaborer expérimentalement une loi de taux à 261,2 K pour la réaction du 1,2-diméthylidènecyclohexane avec le dioxyde de soufre afin de donner le sulfolène correspondant. La réaction était du premier ordre pour le 1,2-diméthylidènecyclohexane, mais du second ordre pour le dioxyde de soufre (voir ci-dessous). Cela a confirmé une prédiction des chimistes théoriciens basée sur des calculs quantiques ab initio de haut niveau. À l'aide de méthodes de calcul, les auteurs ont proposé une structure de transition pour la réaction chélétropique du 1,2-diméthylidènecyclohexane avec le dioxyde de soufre (voir la figure de droite). La réaction est du second ordre pour le dioxyde de soufre car une autre molécule de dioxyde de soufre se lie probablement à l'état de transition pour aider à le stabiliser. Des résultats similaires ont été trouvés dans une étude réalisée en 1995 par Suarez, Sordo et Sordo qui a utilisé des calculs ab initio pour étudier le contrôle cinétique et thermodynamique de la réaction du dioxyde de soufre avec les 1,3-diènes.
d [ 3 ] d t = k 2 [ 1 ] [ S O 2 ] 2 {\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}
Effets des solvants
L'effet du solvant de la réaction chélétropique du 3,4-diméthyl-2,5-dihydrothiophène-1,1-dioxyde (illustré à droite) a été étudié cinématiquement dans 14 solvants. Les constantes de vitesse de réaction de la réaction directe et de la réaction inverse, en plus des constantes d'équilibre, se sont avérées en corrélation linéaire avec l'échelle de polarité des solvants ET(30).
Les réactions ont été effectuées à 120 °C et ont été étudiées par spectroscopie RMN 1H du mélange réactionnel. On a constaté que la vitesse de propagation k1 diminuait d'un facteur de 4,5 en passant du cyclohexane au méthanol. La vitesse inverse k-1 a augmenté d'un facteur de 53 en passant du cyclohexane au méthanol, tandis que la constante d'équilibre Keq a diminué d'un facteur de 140. Il est suggéré qu'il y a un changement de la polarité pendant le processus d'activation comme le montrent les relations entre l'équilibre et les données cinétiques. Les auteurs affirment que la réaction semble être influencée par la polarité du solvant, ce qui peut être démontré par le changement des moments dipolaires lors du passage du réactif à l'état de transition vers le produit. Les auteurs affirment également que la réaction chélétrophique ne semble pas être influencée par l'acidité ou la basicité du solvant.
Les résultats de cette étude conduisent les auteurs à s'attendre aux comportements suivants :
1. Le changement de la polarité du solvant influence moins le taux que l'équilibre.
2. Les constantes de vitesse seront caractérisées par un effet inverse sur la polarité : k1 diminuera légèrement avec l'augmentation de ET(30), et k-1 augmentera dans les mêmes conditions.
3. L'effet sur le k-1 sera plus important que sur le k1.

La réaction du 1,2-diméthylidènecyclohexane avec le SO2 donne une sultine par une réaction hétéro-dimensionnelle sous contrôle cinétique ou un sulfolène par une réaction chélétropique sous contrôle thermodynamique

État de transition proposé pour la réaction du 1,2-diméthylidènecyclohexane avec le SO2 pour donner un sulfolène par une réaction chélétropique
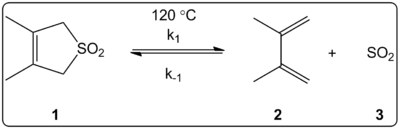
Réaction chélétropique étudiée dans divers solvants
Additions de carbène aux alcènes
L'une des réactions chélétropes les plus importantes sur le plan synthétique est l'addition d'un carbène singulet à un alcène pour former un cyclopropane (voir figure de gauche). Un carbène est une molécule neutre contenant un carbone divalent avec six électrons dans sa couche de valence. De ce fait, les carbènes sont des électrophiles très réactifs et sont générés comme intermédiaires de réaction. Un carbène singulet contient une orbitale p vide et une orbitale hybride à peu près sp2 qui possède deux électrons. Les carbènes singulets s'ajoutent de manière stéréospécifique aux alcènes, et la stéréochimie des alcènes est conservée dans le produit cyclopropane. Le mécanisme d'addition d'un carbène à un alcène est une cycloaddition concertée [2+1] (voir figure). Les carbènes dérivés du chloroforme ou du bromoforme peuvent être utilisés pour ajouter du CX2 à un alcène afin de donner un dihalocyclopropane, tandis que le réactif de Simmons-Smith ajoute du CH2.
L'interaction de l'orbite du carbène rempli avec le système d'alcènes π crée un système à quatre électrons et favorise une approche non linéaire. Il est également favorable de mélanger l'orbitale p vide du carbène avec l'orbitale p remplie de l'alcène π. Un mélange favorable se produit par une approche non linéaire (voir la figure 2 à droite). Cependant, si la théorie favorise clairement une approche non linéaire, il n'y a pas d'implications expérimentales évidentes pour une approche linéaire par rapport à une approche non linéaire.

Ajout d'un carbène à un alcène pour former un cyclopropane

Figure 2. A) Les orbitales pour les Carbènes Singlet B) Approche non linéaire de a) Carbène sp2 Orbital et b) Carbène p Orbital
Questions et réponses
Q : Qu'est-ce qu'une réaction chéletropique ?
R : Une réaction chélatropique est un type de réaction péricyclique où un atome sur l'un des réactifs obtient deux nouvelles liaisons.
Q : Qu'est-ce qu'une réaction péricyclique ?
R : Une réaction péricyclique est une réaction qui implique un état de transition avec un réseau cyclique d'atomes et un réseau cyclique associé d'orbitales en interaction, dans laquelle il y a une réorganisation des liaisons َ et ً.
Q : En quoi diffère-t-elle des autres types de réactions ?
R : Les réactions chélatropiques sont une sous-classe des cycloadditions, et ce qui les distingue des autres types de réactions, c'est que sur l'un des réactifs, les deux nouvelles liaisons se font sur le même atome.
Q : Quels sont les exemples ?
R : Parmi les exemples, citons les "extrusions chélatropiques", comme lorsque l'atome unique du groupe carbonyle se retrouve dans le monoxyde de carbone.
Q : Quel est le moteur de ces réactions ?
R : La force motrice de ces réactions est souvent le bénéfice entropique de la libération d'un gaz (par exemple, CO ou N2).
Q : La figure 1 est-elle liée aux réactions chélatropiques ? R : Oui, la figure 1 montre des exemples de réactions chélatropiques.
Rechercher dans l'encyclopédie
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)