Dioxyde de carbone
Le dioxyde de carbone (CO2) est un composé chimique. C'est un gaz à température ambiante. Il est constitué d'un atome de carbone et de deux atomes d'oxygène. Les hommes et les animaux libèrent du dioxyde de carbone lorsqu'ils expirent. De plus, chaque fois qu'un objet organique est brûlé (ou qu'un feu est allumé), il produit du dioxyde de carbone. Les plantes utilisent le dioxyde de carbone pour fabriquer des aliments. Ce processus est appelé photosynthèse. Les propriétés du dioxyde de carbone ont été étudiées par le scientifique écossais Joseph Black dans les années 1750.
Le dioxyde de carbone est un gaz à effet de serre. Les gaz à effet de serre piègent l'énergie thermique. Les gaz à effet de serre modifient le climat et le temps sur notre planète, la Terre. C'est ce qu'on appelle le changement climatique. Les gaz à effet de serre sont une cause du réchauffement de la planète, de l'augmentation de la température à la surface de la Terre.
Formule structurelle du dioxyde de carbone. C est le carbone et O est l'oxygène. Les doubles lignes représentent la double liaison chimique entre les atomes.
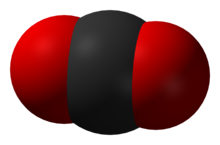
Une image pour montrer simplement comment les atomes peuvent remplir l'espace. Le noir est le carbone et le rouge l'oxygène.
Rôle biologique
Le dioxyde de carbone est un produit final dans les organismes qui obtiennent de l'énergie en décomposant les sucres, les graisses et les acides aminés avec de l'oxygène dans le cadre de leur métabolisme. C'est un processus connu sous le nom de respiration cellulaire. Cela concerne tous les végétaux, les animaux, de nombreux champignons et certaines bactéries. Chez les animaux supérieurs, le dioxyde de carbone circule dans le sang depuis les tissus du corps jusqu'aux poumons où il est expiré. Les plantes absorbent le dioxyde de carbone de l'atmosphère pour l'utiliser dans la photosynthèse.
Glace sèche
La glace sèche, ou dioxyde de carbone solide, est l'état solide du gaz CO2 en dessous de -109,3 °F (-78,5°C). La glace sèche n'existe pas à l'état naturel sur terre, mais elle est fabriquée par l'homme. Elle est incolore. Les gens utilisent la glace sèche pour rendre les choses froides, et pour rendre les boissons pétillantes, tuer les spermophiles et geler les verrues. La vapeur de glace sèche provoque la suffocation et, finalement, la mort. La prudence et l'assistance professionnelle sont recommandées chaque fois que l'on utilise de la glace sèche.
À la pression habituelle, il ne fond pas d'un solide à un liquide, mais passe directement d'un solide à un gaz. C'est ce qu'on appelle la sublimation. Elle passe directement du solide au gaz à toute température supérieure aux températures extrêmement froides. La glace sèche se sublime à la température normale de l'air. La glace sèche exposée à l'air normal dégage du dioxyde de carbone gazeux qui n'a pas de couleur. Le dioxyde de carbone peut être liquéfié à une pression supérieure à 5,1 atmosphères.
Le gaz carbonique qui se dégage de la glace sèche est si froid que lorsqu'il se mélange à l'air, il refroidit la vapeur d'eau présente dans l'air pour former un brouillard qui ressemble à une épaisse fumée blanche. Il est souvent utilisé au théâtre pour créer l'apparence de brouillard ou de fumée.

La glace sèche lorsqu'elle est mise dans l'eau
Isolement et production
Les chimistes peuvent obtenir du dioxyde de carbone à partir de l'air de refroidissement. Ils appellent cela la distillation de l'air. Cette méthode est inefficace car il faut réfrigérer une grande quantité d'air pour extraire une petite quantité de CO2. Les chimistes peuvent également utiliser plusieurs réactions chimiques différentes pour séparer le dioxyde de carbone. Le dioxyde de carbone est produit lors des réactions entre la plupart des acides et la plupart des carbonates métalliques. Par exemple, la réaction entre l'acide chlorhydrique et le carbonate de calcium (calcaire ou craie) produit du dioxyde de carbone :
2 H C l + C a C O 3 ⟶ C a C l 2 + H 2 C O 3 {\displaystyle \mathrm {2\ HCl+CaCO_{3}\longrightarrow CaCl_{2}+H_{2}CO_{3}} }
L'acide carbonique (H2CO3) se décompose ensuite en eau et en CO2. Ces réactions provoquent la formation de mousse ou de bulles, ou les deux. Dans l'industrie, ces réactions sont souvent utilisées pour neutraliser les flux d'acides résiduels.
La chaux vive (CaO), un produit chimique largement utilisé, peut être fabriquée en chauffant le calcaire à environ 850 °C. Cette réaction produit également du CO2 :
C a C O 3 ⟶ C a O + C O 2 {\displaystyle \mathrm {CaCO_{3}\longrightarrow CaO+CO_{2}} }
Le dioxyde de carbone est également produit lors de la combustion de tous les combustibles contenant du carbone, tels que le méthane (gaz naturel), les distillats de pétrole (essence, diesel, kérosène, propane), le charbon ou le bois. Dans la plupart des cas, de l'eau est également libérée. La réaction chimique entre le méthane et l'oxygène en est un exemple :
C H 4 + 2 O 2 ⟶ C O 2 + 2 H 2 O {\displaystyle \mathrm {CH_{4}+2\ O_{2}\longrightarrow CO_{2}+2\ H_{2}O} }
Le dioxyde de carbone est produit dans les aciéries. Le fer est réduit de ses oxydes avec du coke dans un haut fourneau, ce qui produit de la fonte brute et du dioxyde de carbone :
F e 2 O 3 + 3 C O ⟶ 2 F e + 3 C O 2 {\displaystyle \mathrm {Fe_{2}O_{3}+3\ CO\longrightarrow 2\ Fe+3\ CO_{2}} }
La levure métabolise le sucre pour produire du dioxyde de carbone et de l'éthanol, également appelé alcool, dans la production de vins, bières et autres spiritueux, mais aussi dans la production de bioéthanol :
C 6 H 12 O 6 ⟶ 2 C O 2 + 2 C 2 H 5 O H {\displaystyle \mathrm {C_{6}H_{12}O_{6}\longrightarrow 2\ CO_{2}+2\ C_{2}H_{5}OH} }
Tous les organismes aérobies produisent du CO
2 lorsqu'ils oxydent les glucides, les acides gras et les protéines dans les mitochondries des cellules. Le grand nombre de réactions impliquées est extrêmement complexe et difficile à décrire. (Elles comprennent la respiration cellulaire, la respiration anaérobie et la photosynthèse). Les photoautotrophes (c'est-à-dire les plantes, les cyanobactéries) utilisent une autre réaction : Les plantes absorbent le CO
2 de l'air et, avec l'eau, le font réagir pour former des hydrates de carbone :
n C O 2 + n H 2 O ⟶ ( C H 2 O ) n + n O 2 {\displaystyle \mathrm {nCO_{2}+nH_{2}O\longrightarrow (CH_{2}O)n+nO_{2}} }
Le dioxyde de carbone est soluble dans l'eau, dans laquelle il s'interconvertit spontanément entre le CO2 et le H
2CO
3 (acide carbonique). Les concentrations relatives de CO
2, H
2CO
3, et les formes déprotonées HCO-
3 (bicarbonate) et CO2-
3(carbonate) dépendent de l'acidité (pH). Dans une eau neutre ou légèrement alcaline (pH > 6,5), la forme bicarbonate prédomine (>50%) devenant la plus répandue (>95%) au pH de l'eau de mer, alors que dans une eau très alcaline (pH > 10,4) la forme prédominante (>50%) est le carbonate. Les formes bicarbonate et carbonate sont très solubles. Ainsi, l'eau de mer équilibrée en air (légèrement alcaline avec un pH typique = 8,2-8,5) contient environ 120 mg de bicarbonate par litre.
Production industrielle
Le dioxyde de carbone industriel est produit principalement à partir de six processus :
- En captant les sources naturelles de dioxyde de carbone où il est produit par l'action de l'eau acidifiée sur le calcaire ou la dolomite.
- En tant que sous-produit des usines de production d'hydrogène, où le méthane est converti en CO2 ;
- De la combustion de combustibles fossiles ou de bois ;
- Sous-produit de la fermentation du sucre dans le brassage de la bière, du whisky et d'autres boissons alcoolisées ;
- Issu de la décomposition thermique du calcaire, le CaCO
3, dans la fabrication de la chaux (oxyde de calcium, CaO) ;
Réaction chimique
Le dioxyde de carbone peut être créé par une simple réaction chimique :
C + O 2 ⟶ C O 2 {\displaystyle \mathrm {C+O_{2}\longrightarrow CO_{2}} }
carbone + oxygène → dioxyde de carbone
Questions et réponses
Q : Qu'est-ce que le dioxyde de carbone ?
R : Le dioxyde de carbone est un composé chimique acide, composé d'un atome de carbone et de deux atomes d'oxygène, qui se présente sous forme de gaz à température ambiante.
Q : Comment le dioxyde de carbone est-il rejeté dans l'atmosphère ?
R : Les humains et les animaux rejettent du dioxyde de carbone lorsqu'ils expirent, et chaque fois qu'un objet organique est brûlé ou qu'un incendie se déclare.
Q : Qu'est-ce que la photosynthèse ?
R : La photosynthèse est le processus par lequel les plantes utilisent le dioxyde de carbone pour produire de la nourriture.
Q : Qui a étudié les propriétés du dioxyde de carbone ?
R : Le scientifique écossais Joseph Black a étudié les propriétés du dioxyde de carbone dans les années 1750.
Q : Qu'est-ce qu'un gaz à effet de serre ?
R : Un gaz à effet de serre est un gaz qui piège l'énergie thermique et modifie le climat et les conditions météorologiques de la planète.
Q : Comment le dioxyde de carbone contribue-t-il au changement climatique ?
R : Le dioxyde de carbone est un gaz à effet de serre qui contribue au changement climatique en piégeant l'énergie thermique et en provoquant le réchauffement de la planète, c'est-à-dire l'augmentation de la température à la surface de la Terre.
Q : Comment la concentration de dioxyde de carbone dans l'atmosphère terrestre a-t-elle été régulée ?
R : La concentration de dioxyde de carbone dans l'atmosphère terrestre est régulée par les organismes photosynthétiques et les phénomènes géologiques, principalement les volcans, depuis la fin de l'ère précambrienne.
Rechercher dans l'encyclopédie






