Carbocation
Une carbocation est un ion avec un atome de carbone chargé positivement. L'atome de carbone chargé dans une carbocation est un "sextuor" (c'est-à-dire qu'il ne possède que six électrons dans sa coquille de valence extérieure au lieu de huit). Les atomes de carbone avec huit élections de valence ont la stabilité maximale (règle de l'octet). Par conséquent, les carbocations sont souvent réactives, cherchant à remplir l'octet d'électrons de valence ainsi qu'à retrouver une charge neutre. La logique voudrait que les carbocations aient une hybridation sp3 avec une orbite sp3 vide donnant une charge positive. Cependant, la réactivité d'une carbocation ressemble davantage à l'hybridation sp2 avec une géométrie moléculaire plane trigonale.
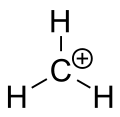
L'ion carbenium du méthane

le cation tert-butyle, démontrant une géométrie plane
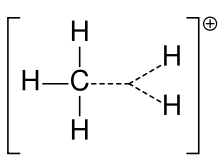
L'ion carbonium du méthane
Définitions
Auparavant, une carbocation était souvent appelée ion carbonium, mais les chimistes s'interrogent sur sa signification exacte. Dans la chimie actuelle, une carbocation est tout atome de carbone chargé positivement. Deux types particuliers ont été suggérés : les ions carbenium sont trivalents et les ions carbonium sont pentavalents ou hexavalents. Les manuels de niveau universitaire n'abordent les carbocations que comme s'il s'agissait d'ions carbenium, ou traitent des carbocations avec une référence fugace à l'ancienne expression "ion carbonium" ou "carbenium et ions carbonium". Un manuel à ce jour conserve l'ancien nom de l'ion carbonium pour l'ion carbenium et réserve l'expression "ion carbenium hypervalent" pour le CH5+.
Histoire
En 1891, G. Merling a signalé qu'il avait ajouté du brome au tropylidène (cycloheptatriène) puis chauffé le produit pour obtenir un matériau cristallin, soluble dans l'eau, C
7H
7Br. Il n'a pas suggéré de structure pour ce produit, mais Doering et Knox ont montré de manière convaincante qu'il s'agissait de bromure de tropylium (cycloheptatrienylium). La règle de Hückel prédit que cet ion est aromatique.
En 1902, Norris et Kehrman ont découvert indépendamment que le triphénylméthanol incolore donnait des solutions jaune foncé dans l'acide sulfurique concentré. Le chlorure de triphénylméthyle formait de la même façon des complexes orangés avec les chlorures d'aluminium et d'étain. En 1902, Adolf von Baeyer a reconnu le caractère salin des composés formés.

Il a appelé la relation entre la couleur et la formation de sel halochromie dont le vert malachite est un excellent exemple.
Les carbocations sont des intermédiaires réactifs dans de nombreuses réactions organiques. Cette idée, proposée pour la première fois par Julius Stieglitz en 1899, a été développée par Hans Meerwein dans son étude de 1922 sur le réarrangement Wagner-Meerwein. On a également découvert que des carbocations étaient impliquées dans la réaction SN1, la réaction E1 et dans des réactions de réarrangement telles que le déplacement de Whitmore 1,2. L'establishment chimique était réticent à accepter la notion de carbocation et pendant longtemps, le Journal of the American Chemical Society a refusé les articles qui en faisaient mention.
Le premier spectre RMN d'une carbocation stable en solution a été publié par Doering et al. en 1958. Il s'agissait de l'ion heptaméthylbenzénonium, obtenu en traitant l'hexaméthylbenzène avec du chlorure de méthyle et du chlorure d'aluminium. Le cation 7-norbornadiényle stable a été préparé par Story et al. en 1960 en faisant réagir du chlorure de norbornadiényle avec du tétrafluoroborate d'argent dans du dioxyde de soufre à -80 °C. Le spectre RMN a établi qu'il était ponté de façon non classique (le premier ion stable non classique observé).
En 1962, Olah a observé directement la carbocation du tert-butyle par résonance magnétique nucléaire comme une espèce stable lors de la dissolution du fluorure de tert-butyle dans l'acide magique. La RMN du cation norbornyl a été signalée pour la première fois par Schleyer et al. et il a été démontré qu'il subit un brouillage de protons par-dessus une barrière par Saunders et al.
Propriétés
En chimie organique, une carbocation est souvent la cible d'une attaque nucléophile par des nucléophiles comme les ions hydroxyle (OH-) ou les ions halogènes.
Les carbocations sont classées comme primaires, secondaires ou tertiaires selon le nombre d'atomes de carbone liés au carbone ionisé. Les carbocations primaires ont un ou zéro atome de carbone fixé au carbone ionisé, les carbocations secondaires ont deux atomes de carbone fixés au carbone ionisé, et les carbocations tertiaires ont trois atomes de carbone fixés au carbone ionisé.
La stabilité de la carbocation augmente avec le nombre de groupes alkyles liés au carbone porteur. Les carbocations tertiaires sont plus stables (et se forment plus facilement) que les carbocations secondaires ; les carbocations primaires sont très instables car, si les carbones ionisés d'ordre supérieur sont stabilisés par hyperconjugaison, les carbones non substitués (primaires) ne le sont pas. Par conséquent, des réactions telles que la réaction SN1 et la réaction d'élimination E1 ne se produisent normalement pas si une carbocation primaire se forme. Une exception à cette règle se produit lorsqu'il y a une double liaison carbone-carbone à côté du carbone ionisé. Des cations tels que le cation allyle CH2=CH-CH2+ et le cation benzyle C6H5-CH2+ sont plus stables que la plupart des autres carbocations. Les molécules qui peuvent former des carbocations allyliques ou benzyliques sont particulièrement réactives.
Les carbocations subissent des réactions de réarrangement, passant de structures moins stables à des structures tout aussi stables ou plus stables avec des constantes de vitesse supérieures à 109/sec. Ce fait complique les voies de synthèse de nombreux composés. Par exemple, lorsque le 3-pentanol est chauffé avec du HCl aqueux, la carbocation du 3-pentyle initialement formée se réarrange en un mélange statistique de 3-pentyle et de 2-pentyle. Ces cations réagissent avec l'ion chlorure pour produire environ 1/3 de 3-chloropentane et 2/3 de 2-chloropentane.
Certaines carbocations, comme le cation norbornyl, présentent une liaison à trois centres plus ou moins symétrique. Les cations de ce type ont été appelés ions non classiques. La différence d'énergie entre les carbocations "classiques" et les isomères "non-classiques" est souvent très faible, et il y a généralement peu, voire aucune énergie d'activation impliquée dans la transition entre les structures "classiques" et "non-classiques". La forme "non-classique" de la carbocation du 2-butyle est essentiellement le 2-butène avec un proton directement au-dessus du centre de ce qui serait la double liaison carbone-carbone. Les carbocations "non-classiques" ont autrefois fait l'objet d'une grande controverse. L'une des plus grandes contributions de George Olah à la chimie a été de résoudre cette controverse.
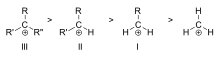
Ordre de stabilité des exemples d'alkylcarbocations tertiaire (III), secondaire (II) et primaire (I)
Carbocations spécifiques
Les cations cyclopropylcarbinyles peuvent être étudiés par RMN :

Dans le spectre RMN d'un dérivé de diméthyle, on trouve deux signaux non équivalents pour les deux groupes méthyle, ce qui indique que la conformation moléculaire de ce cation n'est pas perpendiculaire (comme en A) mais qu'il est bissecté (comme en B) avec le p-orbital vide et le système cyclique cyclopropylique dans le même plan :

En termes de théorie des liaisons courbes, cette préférence s'explique en supposant un chevauchement orbital favorable entre les liaisons courbes du cyclopropane rempli et le p-orbital vide.
Questions et réponses
Q : Qu'est-ce qu'un carbocation ?
R : Un carbocation est un ion dont l'atome de carbone est chargé positivement.
Q : Quelle est l'enveloppe de valence externe d'un carbocation ?
R : L'enveloppe de valence externe d'un carbocation ne comporte que six électrons au lieu des huit électrons de valence stables.
Q : Pourquoi les carbocations sont-ils souvent réactifs ?
R : Les carbocations sont souvent réactifs parce qu'ils cherchent à remplir l'octuplet d'électrons de valence et à retrouver une charge neutre.
Q : Quelle est la stabilité maximale des atomes de carbone ?
R : La stabilité maximale des atomes de carbone est atteinte lorsqu'ils possèdent huit électrons de valence.
Q : Qu'est-ce qu'un sextuor en chimie ?
R : Un sextet est un terme utilisé pour décrire un atome de carbone dans un carbocation qui n'a que six électrons dans son enveloppe de valence externe au lieu des huit électrons de valence stables.
Q : Quelles sont l'hybridation et la géométrie moléculaire d'un carbocation ?
R : Bien que la logique voudrait que les carbocations aient une hybridation sp3 avec une orbitale sp3 vide donnant une charge positive, leur réactivité ressemble davantage à une hybridation sp2 avec une géométrie moléculaire planaire trigonale.
Q : Qu'est-ce que la règle de l'octuor ?
R : La règle de l'octuor est un principe de chimie selon lequel les atomes ont tendance à former des liaisons chimiques avec d'autres atomes qui permettent aux deux atomes d'avoir un ensemble stable de huit électrons de valence.
Rechercher dans l'encyclopédie