Benzène
Le benzène, également connu sous le nom de benzol, est un composé chimique organique de formule C6H6. C'est un liquide incolore et inflammable à l'odeur douce. Les molécules de benzène sont un cycle de six atomes de carbone qui sont chacun liés à un atome d'hydrogène. Il s'agit d'un composé aromatique, ce qui signifie que le cycle comporte des doubles liaisons alternées.
Le benzène est cancérigène, ce qui signifie qu'il peut causer le cancer. Il a de nombreuses utilisations dans le monde réel. Il est utilisé comme additif dans l'essence, les plastiques, le caoutchouc synthétique, les teintures et c'est un solvant industriel, ce qui signifie qu'il peut dissoudre de nombreuses autres molécules chimiques. Le benzène est également une partie naturelle du pétrole brut et est donc présent dans l'essence. De nombreux médicaments contiennent des parties fabriquées à partir de benzène.
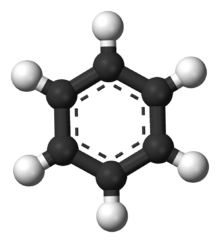
Modèle d'une molécule de benzène. Les atomes de carbone sont représentés en noir et l'hydrogène en blanc.
_1964,_MiNr_440.jpg)
En 1964, le service postal allemand a émis un timbre en commémoration des 100 ans de la découverte du benzène
Structure
Le benzène possède des propriétés particulières appelées aromaticité. Les six atomes de carbone du cycle se trouvent tous sur le même plan plat. Pour tenir compte de toutes les liaisons sur un cycle à six atomes de carbone, il doit y avoir des doubles liaisons carbonées alternées (système conjugué) :
Si le benzène avait trois doubles liaisons, trois côtés de son cycle seraient plus courts que les trois autres. La diffraction des rayons X montre que les six liaisons carbone-carbone du benzène sont toutes de la même longueur de 140 picomètres (pm). Les longueurs des liaisons C-C sont supérieures à une double liaison (135 pm) mais plus courtes qu'une simple liaison (147 pm). Cette distance intermédiaire correspond à une délocalisation des électrons : les électrons pour la liaison C-C sont répartis de manière égale entre chacun des six atomes de carbone. La molécule est planaire. Une représentation est que la structure existe comme une superposition de structures dites de résonance, plutôt que l'une ou l'autre forme individuellement. (En d'autres termes, les doubles liaisons de la molécule passent rapidement d'une paire d'atomes de carbone à l'autre). La délocalisation des électrons est l'une des explications de la stabilité thermodynamique du benzène et des composés aromatiques apparentés. Il est probable que cette stabilité contribue aux propriétés moléculaires et chimiques particulières connues sous le nom d'aromaticité. Pour indiquer la nature délocalisée de la liaison, le benzène est souvent représenté avec un cercle à l'intérieur d'un arrangement hexagonal d'atomes de carbone.
Comme c'est souvent le cas en chimie organique, les atomes de carbone du diagramme ci-dessus n'ont pas été étiquetés. En réalisant que chaque carbone a 2p électrons, chaque carbone donne un électron dans l'anneau délocalisé au-dessus et au-dessous de l'anneau de benzène. C'est le chevauchement des p-orbitaux au-dessus et au-dessous du cycle qui produit les nuages pi.
En 1986, certains chimistes ont contesté la vision délocalisée du benzène dans un article publié dans la revue Nature. Ils ont montré que les électrons du benzène sont presque certainement localisés sur des atomes de carbone particuliers. Ils ont montré que les propriétés aromatiques du benzène proviennent du couplage de spin plutôt que de la délocalisation des électrons. D'autres scientifiques ont écrit des articles pour soutenir ce point de vue dans Nature en 1987. Mais les chimistes sont lents à passer du point de vue des électrons délocalisés.
Les dérivés du benzène sont suffisamment fréquents en tant que composants de molécules organiques pour qu'il existe un symbole Unicode dans le bloc Miscellaneous Technical avec le code U+232C (⌬) pour le représenter par trois doubles liaisons, et U+23E3 (⏣) pour une version délocalisée.
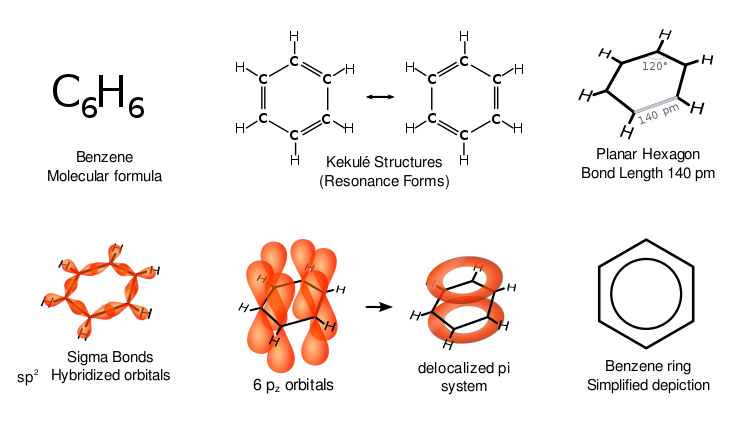
Les différentes représentations du benzène
Questions et réponses
K: Mitä on bentseeni?
V: Bentseeni on orgaaninen kemiallinen yhdiste.
K: Mikä on bentseenin kemiallinen kaava?
V: Bentseenin kemiallinen kaava on C6H6.
K: Miltä bentseeni näyttää ja tuoksuu?
V: Bentseeni on väritön ja syttyvä neste, jolla on makea haju.
K: Mikä on bentseenimolekyylin rakenne?
V: Bentseenimolekyyli on rengas, jossa on kuusi hiiliatomia, jotka kukin ovat sitoutuneet yhteen vetyatomiin. Se on aromaattinen yhdiste, eli renkaassa on vuorotellen kaksoissidoksia.
K: Onko bentseeni syöpää aiheuttava?
V: Kyllä, bentseeni on karsinogeeninen eli se voi aiheuttaa syöpää.
Kysymys: Millaisia ovat bentseenin reaalimaailman käyttötarkoitukset?
V: Bentseeniä käytetään lisäaineena bensiinissä, muoveissa, synteettisessä kumissa, väriaineissa ja se on teollinen liuotin, mikä tarkoittaa, että se voi liuottaa monia muita kemiallisia molekyylejä. Monet lääkkeet sisältävät myös bentseenistä valmistettuja osia.
K: Missä bentseeniä esiintyy?
V: Bentseeni on raakaöljyn luonnollinen osa ja sitä esiintyy siksi bensiinissä.
Rechercher dans l'encyclopédie