État de transition
Dans une réaction chimique, l'état de transition est le point où il y a une valeur maximale d'énergie. Cette énergie est appelée l'énergie d'activation. Lorsque deux ou plusieurs molécules sont mélangées, elles se heurtent les unes aux autres. Si elles se heurtent avec suffisamment d'énergie pour passer par l'état de transition, elles réagiront et formeront de nouvelles molécules. À l'état de transition, de nouvelles liaisons sont formées tandis que les anciennes sont rompues. Dans un graphique ou un dessin, l'état de transition est souvent marqué par le symbole de la double dague ‡.
Il est très difficile d'étudier un état de transition. En effet, il est si riche en énergie que les molécules restent sous cette forme pendant un temps très court, généralement des femtosecondes. Il est important de ne pas confondre les états de transition avec les intermédiaires. Les intermédiaires se trouvent à des points d'énergie minimale et peuvent vivre très longtemps. Comme un état de transition, cependant, un intermédiaire se trouve entre les réactifs et les produits d'une réaction.
L'étude des états de transition est très importante pour comprendre les mécanismes de réaction. Il existe des théories et des programmes informatiques qui peuvent être utilisés pour calculer à quoi ressemble l'état de transition. C'est une partie de la cinétique chimique.
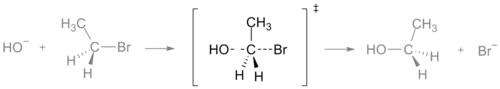
L'état de transition d'une réaction SN2
Questions et réponses
Q : Qu'est-ce que l'état de transition dans une réaction chimique ?
R : L'état de transition est le point où la valeur de l'énergie est maximale dans une réaction chimique.
Q : Qu'est-ce que l'énergie d'activation dans une réaction chimique ?
R : L'énergie requise pour qu'une réaction se produise s'appelle l'énergie d'activation.
Q : Que se passe-t-il lorsque deux molécules ou plus sont mélangées dans une réaction chimique ?
R : Lorsque deux molécules ou plus sont mélangées, elles se heurtent l'une l'autre. Si elles se heurtent avec suffisamment d'énergie pour passer par l'état de transition, elles réagiront et formeront de nouvelles molécules.
Q : À quoi sert le symbole de la double dague (‡) dans un graphique ou un dessin d'une réaction chimique ?
R : Le symbole de la double dague (‡) est utilisé pour marquer l'état de transition dans un graphique ou un dessin d'une réaction chimique.
Q : Pourquoi est-il difficile d'étudier l'état de transition dans une réaction chimique ?
R : Il est très difficile d'étudier l'état de transition dans une réaction chimique parce qu'il est tellement énergétique que les molécules ne restent sous cette forme que très peu de temps, généralement quelques femtosecondes.
Q : Qu'est-ce qu'un intermédiaire dans une réaction chimique ?
R : Un intermédiaire est une molécule qui se trouve à des points d'énergie minimum dans une réaction chimique et qui peut vivre très longtemps.
Q : Pourquoi l'étude des états de transition est-elle importante pour comprendre les mécanismes de réaction ?
R : L'étude des états de transition est importante pour comprendre les mécanismes de réaction car elle permet de déterminer comment une réaction se produit et comment la contrôler ou la manipuler.
Rechercher dans l'encyclopédie